Especialistas desenvolvem maneira de aproveitar a tecnologia CRISPR para lidar com a resistência antimicrobiana
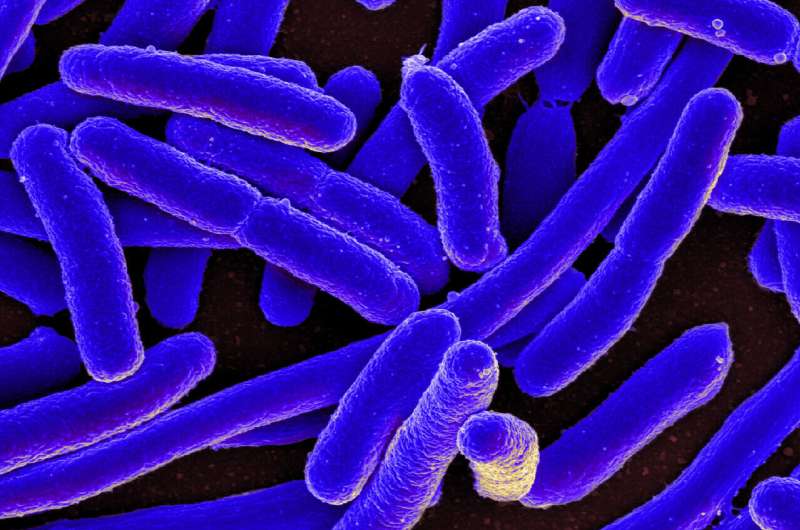 Uma micrografia eletrônica de varredura de Escherichia coli, que é uma das muitas cepas de bactérias encontradas no intestino de mamíferos. Crédito:Instituto Nacional de Alergia e Doenças Infecciosas, Institutos Nacionais de Saúde
Uma micrografia eletrônica de varredura de Escherichia coli, que é uma das muitas cepas de bactérias encontradas no intestino de mamíferos. Crédito:Instituto Nacional de Alergia e Doenças Infecciosas, Institutos Nacionais de Saúde A resistência antimicrobiana (RAM) continua a aumentar a nível mundial, com as taxas de RAM na maioria dos agentes patogénicos a aumentar e a ameaçar um futuro em que todos os dias os procedimentos médicos poderão já não ser possíveis e as infecções que se pensava serem tratadas há muito tempo poderão voltar a matar regularmente. Como tal, são de vital necessidade novas ferramentas para combater a RAM.
Uma nova revisão de pesquisa no Congresso Global ESCMID deste ano (anteriormente ECCMID – Barcelona, 27 a 30 de abril) mostra como a mais recente tecnologia de edição de genes CRISPR-Cas pode ser usada para ajudar a modificar e atacar bactérias AMR. A apresentação é do Dr. Rodrigo Ibarra-Chávez, Departamento de Biologia, Universidade de Copenhague, Dinamarca.
A tecnologia de edição genética CRISPR-Cas é um método inovador em biologia molecular que permite alterações precisas nos genomas dos organismos vivos. Esta técnica revolucionária, que rendeu às suas inventoras, Jennifer Doudna e Emmanuelle Charpentier, o Prémio Nobel da Química em 2020, permite aos cientistas identificar e modificar com precisão segmentos específicos do ADN (código genético) de um organismo.
Funcionando como uma “tesoura” molecular com a orientação do RNA guia (gRNA), o CRISPR-Cas pode cortar o DNA em pontos designados. Esta ação facilita a eliminação de genes indesejados ou a introdução de novo material genético nas células de um organismo, abrindo caminho para terapias avançadas.
Ibarra-Chávez diz:"Combatendo fogo com fogo, estamos usando sistemas CRISPR-Cas (um sistema de imunidade bacteriana) como uma estratégia inovadora para induzir a morte de células bacterianas ou interferir na expressão da resistência a antibióticos - ambos são promissores como novas sequências específicas 'antimicrobianos' direcionados.
Uma linha de seu trabalho envolve a criação de sistemas guiados contra genes de resistência antimicrobiana que possam tratar infecções e prevenir a disseminação de genes de resistência.
Elementos genéticos móveis (MGEs) são partes do genoma bacteriano que podem se mover para outras células hospedeiras ou também transferir para outra espécie. Esses elementos impulsionam a evolução bacteriana por meio da transferência horizontal de genes. Ibarra-Chávez explica como o reaproveitamento de elementos genéticos móveis (MGEs) e a escolha do mecanismo de entrega envolvido na estratégia antimicrobiana são importantes para atingir a bactéria alvo.
Um fago é um vírus que infecta bactérias e também é considerado MGE, pois alguns podem permanecer inativos na célula hospedeira e se transferir verticalmente. Os MGEs que sua equipe está usando são satélites de fagos, que são parasitas de fagos.
Ele diz:"Esses 'satélites de fagos' sequestram partes das partículas virais dos fagos para garantir sua transferência para as células hospedeiras. Em contraste com os fagos, os satélites podem infectar bactérias sem destruí-las, oferecendo uma mudança radical em relação aos métodos existentes envolvendo fagos e, portanto, desenvolvendo um arsenal de partículas virais que são seguras para uso em aplicações como detecção e modificação por meio de entrega de genes.
"As partículas fágicas são muito estáveis e fáceis de transportar e aplicar em ambientes médicos. É nossa tarefa desenvolver diretrizes seguras para sua aplicação e compreender os mecanismos de resistência que as bactérias podem desenvolver."
As bactérias podem desenvolver mecanismos para escapar da ação do sistema CRISPR-Cas e os vetores de entrega podem ser vulneráveis às defesas anti-MGE. Assim, a equipe do Dr. Ibarra-Chávez e outros estão desenvolvendo o uso de anti-CRISPRs e inibidores de defesa nas cargas úteis de entrega para combater essas defesas, para permitir que o CRISPR chegue e ataque os genes AMR na célula.
Ibarra-Chávez também discute como estratégias combinadas empregando sistemas CRISPR-Cas poderiam promover a suscetibilidade a antibióticos em uma população bacteriana alvo. Os fagos exercem uma pressão seletiva específica sobre as células AMR, o que pode melhorar o efeito de alguns antibióticos. Da mesma forma, usando CRISPR-Cas em combinação com fagos e/ou antibióticos, é possível suprimir os mecanismos de resistência que as bactérias infecciosas podem desenvolver, visando tais genes de virulência/resistência, tornando estas terapias mais seguras.
Ele explica:“As bactérias são particularmente boas em se adaptar e se tornarem resistentes. Acredito que precisamos ser cautelosos e tentar usar estratégias combinatórias para evitar o desenvolvimento de resistência, ao mesmo tempo em que monitoramos e criamos diretrizes para novas tecnologias”.
O Dr. Ibarra-Chávez concentrou-se principalmente no combate à resistência em Staphylococcus aureus e Escherichia coli. Agora, em colaboração com a professora Martha Clokie e o professor Thomas Sicheritz-Pontén, sua equipe tratará a infecção necrosante de tecidos moles por estreptococos do grupo A (bactérias carnívoras) usando as abordagens combinadas descritas acima.
