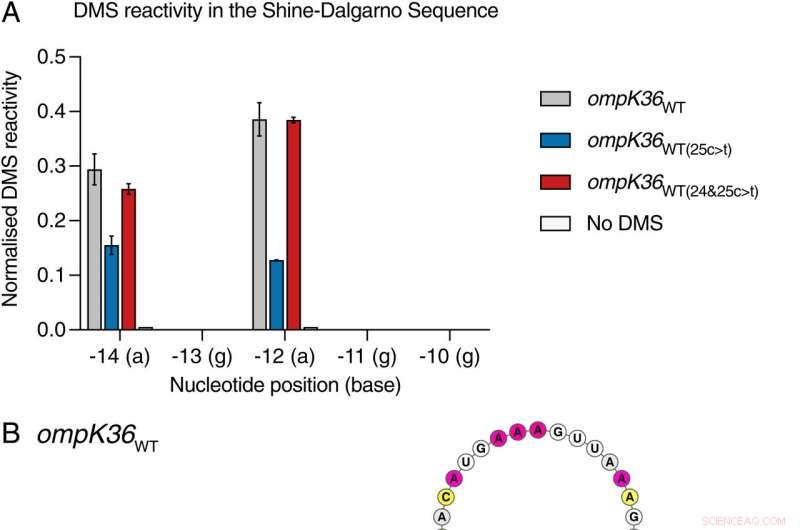
Posição 25 no ompK36WT(25c> t) O RNA induz uma haste envolvendo o SDS. (A) Sinal DMS normalizado lado a lado por nucleotídeo no SDS de ompK36 de comprimento total transcrito in vitro e redobradoWT , ompK36WT(25c> t) , ompk36WT(24&25c> t) , e ompK36 não tratado com DMSWT . Valores mais altos correspondem a acessibilidade de base aumentada. Sinal DMS (± SD) de 2 repetições biológicas para nucleotídeos -14a a -10g são mostrados. (B-D). Modelos de estrutura restrita por DMS da extremidade 5′ de ompK36WT (B), ompK36WT(24&25c>t) (C), e ompK36WT(25c>t) (D). Os nucleotídeos são coloridos pelo sinal DMS normalizado. As SDS nas estruturas de RNA estão destacadas em cinza. As setas indicam a posição -14 e a posição 25c> t em ompK36WT(25c> t) . Crédito:Proceedings of the National Academy of Sciences (2022). DOI:10.1073/pnas.2203593119
Pesquisadores descobriram uma nova maneira de infecções adquiridas em hospitais resistirem a antibióticos, por meio de uma mutação genética "silenciosa".
As bactérias podem adquirir resistência aos antibióticos por meio de mutações aleatórias em seu DNA que lhes proporcionam uma vantagem que as ajuda a sobreviver. Encontrar mutações genéticas e descobrir como elas ajudam as bactérias a sobreviver ao ataque de antibióticos é fundamental para nos ajudar a lutar com novos medicamentos.
Os pesquisadores descobriram agora uma mutação "silenciosa" no código genético que leva à resistência aos antibióticos. Normalmente, mutações desse tipo seriam negligenciadas e já podem estar presentes em outras bactérias infecciosas.
A equipe, liderada por pesquisadores do Imperial College London e incluindo colaboradores internacionais, publicou seus resultados hoje na revista
Proceedings of the National Academy of Sciences .
Resistência crescente Os pesquisadores analisaram a bactéria Klebsiella pneumoniae, que causa infecções nos pulmões, sangue e feridas de pessoas em hospitais, com pacientes com sistema imunológico comprometido, como os de unidades de terapia intensiva, sendo especialmente vulneráveis.
Como muitas bactérias, a K. pneumoniae está se tornando cada vez mais resistente a antibióticos, particularmente a uma família de medicamentos chamados carbapenêmicos. Esses importantes medicamentos de último recurso são usados em hospitais quando outros antibióticos já falharam.
Como o aumento da resistência aos carbapenêmicos pode afetar drasticamente nossa capacidade de tratar infecções, o K. pneumoniae resistente aos carbapenêmicos é classificado como organismos "críticos" de Prioridade 1 da Organização Mundial da Saúde.
Para serem eficazes, os antibióticos precisam penetrar nas bactérias, e em K. pneumoniae isso acontece por meio de um canal na membrana externa da bactéria, formado por uma proteína chamada OmpK36. A equipe descobriu uma mutação genética que faz com que as bactérias produzam menos proteína, efetivamente fechando alguns desses canais e mantendo os antibióticos carbapenêmicos fora.
Mutações 'silenciosas' Essa mutação, no entanto, funciona de maneira diferente das mutações padrão que resultam em resistência a antibióticos. Normalmente, as mutações alteram o código genético de modo que, quando ele é "lido" pelos ribossomos e convertido em proteína, produz uma cadeia diferente de aminoácidos com funções diferentes.
Essa mutação ainda produz a mesma cadeia de aminoácidos, mas altera a estrutura de um importante intermediário de mRNA, impedindo que os ribossomos leiam o código e produzam proteína a partir dele.
Ao procurar por mutações, as técnicas genômicas geralmente procuram alterações na sequência de aminoácidos. No entanto, como essa mutação altera uma estrutura, e não a sequência em si, pode ser considerada uma mutação "silenciosa".
O primeiro autor Dr. Joshua Wong, do Departamento de Ciências da Vida do Imperial, disse:"Na era do big data e da genômica, mutações como as que descobrimos podem ser consideradas 'silenciosas', pois o código genético resulta na mesma sequência de proteínas .
"Esta descoberta deve mudar a forma como vemos o código genético das bactérias e potencialmente indica que nós, na comunidade científica, negligenciamos outras mutações semelhantes que podem ter efeitos importantes. Nosso trabalho se concentra em uma única mutação, mas muda fundamentalmente a forma como interpretamos as mutações, especialmente aquelas que foram pensados para serem silenciosos."
Impulsionado pelo uso de antibióticos A equipe da Imperial, que caracterizou a mutação, trabalhou com equipes da Universidade de Oxford, da Universidade de Florença e da Universidade de Harvard para identificar a distribuição da mutação globalmente, avaliar os níveis de resistência e determinar como a mutação afetou o mRNA intermediário estrutura.
Usando dados de amostras de bactérias resistentes coletadas globalmente, a equipe mostrou que a mutação surgiu várias vezes de forma independente. Isso sugere que não é aleatório e, em vez disso, é impulsionado pela necessidade da bactéria se defender contra os antibióticos.
O pesquisador chefe Gad Frankel, do Departamento de Ciências da Vida do Imperial, disse:"A mutação evoluiu em várias ocasiões de forma independente, e isso nos diz que esse novo mecanismo não é um acaso único, mas sim impulsionado pelo consumo de antibióticos. sugere que a mutação ocorre sob pressão de antibióticos e destaca os efeitos colaterais do uso excessivo de antibióticos em hospitais e outros ambientes".
A equipe agora espera que sua descoberta seja incorporada a ferramentas de bioinformática que analisam sequências genéticas para identificar a presença da mutação, como foi feito com um mecanismo anterior que a equipe descobriu.
Eles também continuarão a trabalhar com seus colaboradores para procurar outras mutações importantes nesse patógeno-chave.
+ Explorar mais Superbactéria comum resistente a medicamentos desenvolve resistência rápida ao antibiótico de 'último recurso'
