Mistério CRISPR desbloqueado:um novo aliado contra a resistência aos antibióticos?
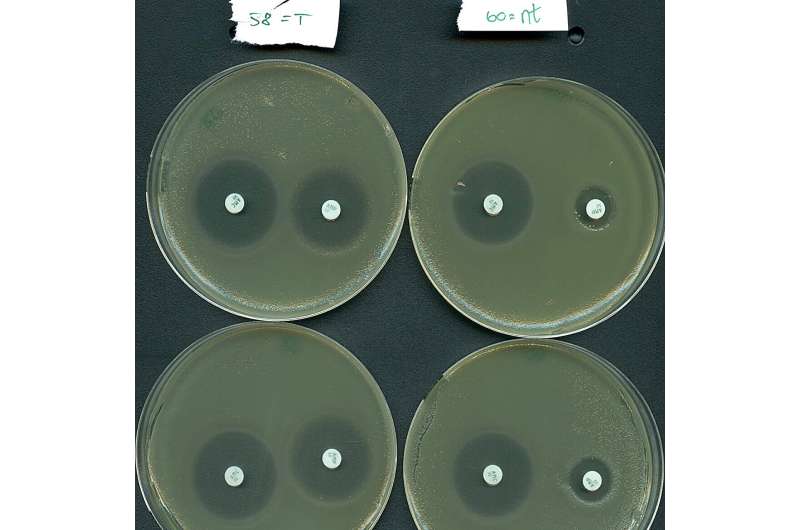 Resultados do ensaio de ressensibilização de resistência a antibióticos mediado por CRISPR-Cas Tipo IV-A3 conduzido pelos pesquisadores. Crédito:Fabienne Benz
Resultados do ensaio de ressensibilização de resistência a antibióticos mediado por CRISPR-Cas Tipo IV-A3 conduzido pelos pesquisadores. Crédito:Fabienne Benz Os sistemas CRISPR-Cas revolucionaram a biotecnologia ao oferecer maneiras de editar genes como uma tesoura programável. Na natureza, as bactérias utilizam estes sistemas para combater vírus mortais. Uma recente colaboração internacional liderada pela Universidade de Copenhaga lançou luz sobre os mais enigmáticos sistemas CRISPR-Cas; o sistema tipo IV. Embora estes sistemas atípicos não cortem genes, as suas funções únicas mostram-se promissoras na nossa luta contra a resistência aos antibióticos.
Os sistemas CRISPR-Cas são sistemas imunológicos adaptativos bacterianos que têm como alvo e cortam os ácidos nucléicos (DNA/RNA) de parasitas genéticos invasores, como bacteriófagos (fagos); vírus que infectam – e eventualmente matam – células bacterianas. Consistem em dois componentes principais; o array CRISPR, que armazena memória imunológica de infecções virais passadas, e os genes cas (que codificam proteínas Cas), responsáveis por coordenar os diferentes estágios da resposta imune.
Atualmente existem seis tipos conhecidos de sistemas CRISPR-Cas, classificados de acordo com suas composições proteicas. Todos os tipos, exceto o tipo IV, incluem nucleases para clivagem de DNA/RNA.
Os sistemas CRISPR-Cas ganharam popularidade como ferramentas de edição de genes, permitindo cortes programáveis precisos em locais genômicos específicos – levando, em última análise, à concessão do Prêmio Nobel de Química de 2020 pelo desenvolvimento desta tecnologia.
Resolvendo o mistério dos componentes ausentes
"Os sistemas Tipo IV são primos estranhos entre os sistemas CRISPR-Cas, pois não possuem o módulo de aquisição de memória imunológica e o componente de corte de DNA que tornaram os sistemas CRISPR-Cas tão famosos. Essas características e sua estrita associação com moléculas circulares móveis de DNA, chamados plasmídeos, motivaram-nos a assumir a tarefa de resolver o seu papel intrigante e as funções moleculares subjacentes", explica Fabienne Benz, pós-doutoranda da Universidade de Copenhaga e co-autora de um estudo sobre este tema publicado em Cell Host &Microbe .
Sendo a marca registrada do CRISPR-Cas a capacidade de cortar DNA em locais específicos, os sistemas Tipo IV operam de uma maneira totalmente diferente. Eles não possuem a típica “tesoura” de nuclease, mas em vez disso abrigam uma helicase DinG – uma proteína misteriosa que desenrola o DNA.
"O ponto de viragem nesta investigação ocorreu quando percebemos que os sistemas do tipo IV não cortam o ADN. Em vez disso, descobrimos que silenciam a expressão genética nos seus locais-alvo. Esta é uma funcionalidade única que pode ter importantes aplicações biotecnológicas", diz Rafael Pinilla. -Redondo, Professor Auxiliar do Departamento de Biologia e coordenador principal da investigação.
Os investigadores alcançaram outro avanço quando resolveram como estes sistemas podem funcionar sem os componentes necessários para criar memória imunitária.
"Os sistemas Tipo IV podem contornar a falta de um módulo de aquisição de memória sequestrando módulos compatíveis de outros sistemas CRISPR-Cas presentes na bactéria hospedeira. Isso é fascinante porque esses outros sistemas estão apenas remotamente relacionados", explica Sarah Camara-Wilpert, co- primeiro autor deste estudo.
Ferramenta CRISPR promissora para combater superbactérias
Mas por que tanto entusiasmo? Bem, acontece que os sistemas do Tipo IV têm uma tendência acentuada de atingir naturalmente os plasmídeos, em vez dos vírus bacterianos. É importante ressaltar que os plasmídeos alvo frequentemente abrigam múltiplos genes de resistência a antibióticos, como aqueles encontrados em superbactérias hospitalares. Estima-se que a resistência antimicrobiana seja diretamente responsável por mais de 1 milhão de mortes anualmente devido à falha do tratamento.
Inspiradas pela sua função natural de direcionamento de plasmídeos, as equipes de pesquisa reprogramaram efetivamente um sistema tipo IV para silenciar seletivamente genes de resistência transportados por uma bactéria de alto risco de pacientes hospitalizados.
“Os nossos resultados indicam que os sistemas Tipo IV têm potencial como um novo meio de combater a resistência aos antibióticos, uma vez que fomos capazes de ressensibilizar um importante agente patogénico ao tratamento com antibióticos”, afirma o professor Søren Sørensen, co-último autor do estudo.
Este estudo foi um grande esforço interdisciplinar envolvendo sete grupos de pesquisa internacionais de vários países. Embora o projeto tenha começado como uma colaboração entre apenas dois grupos, gradualmente ganhou impulso, atraindo parceiros com conhecimentos diversos.
"Experimentamos um maravilhoso efeito de bola de neve, onde cada novo parceiro ampliou o impacto do trabalho, compartilhando suas habilidades únicas e fornecendo insights cruciais para resolver os mistérios que cercam os sistemas do tipo IV. Tem sido um tour-de-force colaborativo, exatamente como a ciência deveria ser", observa Pinilla-Redondo.
