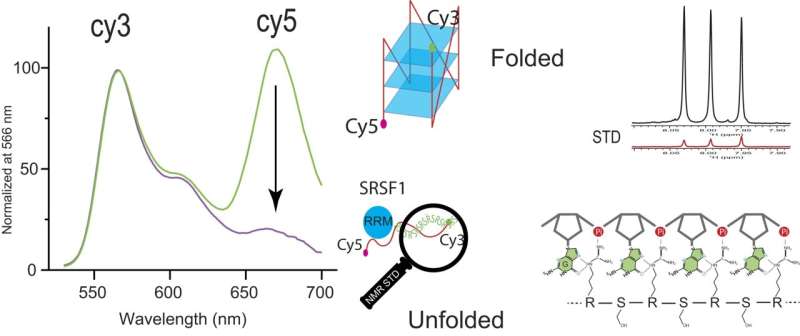
Pesquisadores descobrem a capacidade incomum da proteína SRSF1 de ligar e desdobrar RNA G-quadruplexes
 Crédito:Pesquisa de Ácidos Nucleicos (2024). DOI:10.1093/nar/gkae213
Crédito:Pesquisa de Ácidos Nucleicos (2024). DOI:10.1093/nar/gkae213
A transcrição de RNA é o processo genômico no qual uma célula produz uma duplicata da sequência de DNA de um gene. Em um estudo publicado na Nucleic Acids Research , Professor Jun Zhang, Ph.D., do Departamento de Química da Universidade do Alabama em Birmingham, e sua equipe revelam como a proteína SRSF1 possui a nova função de ligação e desdobramento de complexos quádruplos de guanina de RNA.
