As descobertas sugerem que o ILF3 pode funcionar como um leitor de loops R teloméricos para ajudar a manter a homeostase dos telômeros
 Resumo gráfico. Crédito:Proteína e Célula (2023). DOI:10.1093/procel/pwad054
Resumo gráfico. Crédito:Proteína e Célula (2023). DOI:10.1093/procel/pwad054 Loops R desregulados podem causar garfos de replicação paralisados e instabilidade dos telômeros. No entanto, a forma como os R-loops são reconhecidos e regulados ainda não é bem compreendido, especialmente nos telômeros.
Em um novo estudo, os pesquisadores usaram a tecnologia de identificação de biotina dependente de proximidade (BioID) para identificar o interactoma ILF3 e descobriram que o ILF3 interage com várias helicases de DNA/RNA, incluindo DHX9. Esta interação sugere que o ILF3 pode facilitar a resolução das alças R teloméricas, evitando assim a recombinação homóloga anormal e mantendo a homeostase dos telômeros.
O trabalho, intitulado "ILF3 protege os telômeros da recombinação homóloga aberrante como um leitor telomérico de loop R", foi publicado na revista Protein &Cell. .
As principais conclusões do estudo incluem:
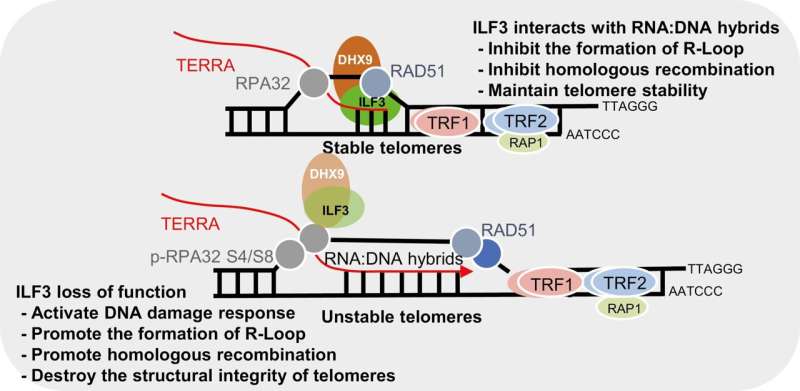
- ILF3 exibe interação seletiva com R-loops teloméricos, protegendo assim os telômeros contra recombinação homóloga aberrante.
- A perda de função do ILF3 eleva consequentemente os níveis de TERRA, desencadeando o acúmulo de loops R nos telômeros. Esse acúmulo induz resposta a danos no DNA (DDR) e disfunção dos telômeros, caracterizada por TIFs elevados, fragilidade dos telômeros e presença de fragmentos de telômeros extracromossômicos, que podem, por sua vez, ativar a via ALT.
- Além disso, o mapeamento do interactoma ILF3 revelou interações com várias helicases de DNA/RNA, incluindo DHX9, com uma implicação significativa de que o ILF3 potencialmente auxilia na resolução de loops R teloméricos através de sua interação com DHX9.
- O ILF3 atua potencialmente como um leitor de R-loops teloméricos, auxiliando na prevenção de recombinação homóloga aberrante e na manutenção da homeostase dos telômeros.
Estes resultados apoiam que o ILF3 interage com estruturas híbridas teloméricas de RNA:DNA, como R-loops, e promove a resolução ou inibe o acúmulo excessivo de R-loops através da RNA helicase DHX9.
Esta pesquisa fornece novos insights sobre a regulação das alças R teloméricas e os mecanismos que mantêm a homeostase dos telômeros, com implicações para a biologia do envelhecimento.
