Novos insights sobre enzimas de fermentação reduzirão a pegada de carbono da indústria química
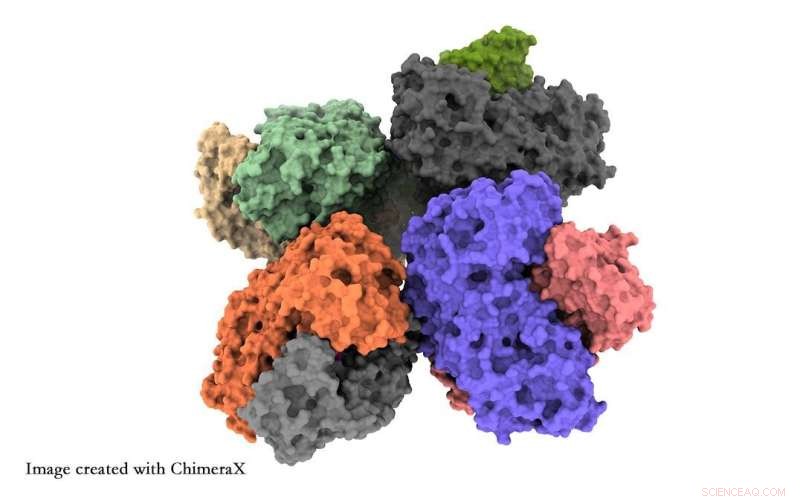
Pesquisadores da Universidade de Tsukuba obtiveram informações em nível atômico sobre a estrutura da enzima fosfocetolase, o que ajudará os pesquisadores a otimizar essa enzima para a síntese de matéria-prima química. Crédito:Universidade de Tsukuba
Produtos farmacêuticos, plásticos e outras indústrias usam enzimas para ajudar a sintetizar matérias-primas moleculares. Enzimas retiradas diretamente de micróbios, como bactérias, geralmente não são ideais para uso industrial; um problema é que eles muitas vezes não sobrevivem às temperaturas elevadas que aceleram uma síntese. A engenharia genética pode ajudar a adaptar as enzimas para esses fins. O conhecimento da estrutura exata átomo por átomo da enzima original é importante para entender a função da enzima na natureza, fornecendo assim uma visão de como otimizar a engenharia genética de enzimas. No entanto, a cristalografia de raios X, uma técnica comum para determinar a estrutura de uma enzima como uma etapa crítica nesse processo, infelizmente também pode alterar sua estrutura.
Uma técnica conhecida como microscopia eletrônica criogênica (crio-EM) pode fornecer um nível de detalhe estrutural semelhante ao da cristalografia de raios-X, mantendo a estrutura da enzima nativa. De fato, o Prêmio Nobel de Química de 2017 foi concedido por usar essa técnica para determinar a estrutura de moléculas biológicas. Agora, em um estudo publicado recentemente no
Journal of Structural Biology , pesquisadores da Universidade de Tsukuba e parceiros colaboradores usaram crio-EM para determinar a estrutura da enzima de fermentação fosfocetolase. Este trabalho facilitará a engenharia genética da enzima para sínteses industriais.
“A cristalografia de raios-X revolucionou a forma como os pesquisadores identificam as estruturas das proteínas, mas o desenvolvimento de meios alternativos que refletem melhor as estruturas observadas na biologia é inestimável”, explica o autor sênior, professor Kenji Iwasaki. "Nosso uso de crio-EM como uma ferramenta de imagem revelou detalhes estruturais anteriormente obscuros na fosfocetolase que beneficiarão diretamente a indústria química".
Os pesquisadores relatam duas descobertas principais. Primeiro, oito unidades de fosfocetolase se agrupam em uma estrutura, conhecida como octâmero. Em segundo lugar, eles observaram detalhes de uma cadeia de aminoácidos conhecida como alça QN que pode ditar se o local funcional da enzima é aberto ou fechado. Este é um meio possível de aumentar a produção química da enzima.
A cristalografia de raios X obscurece os detalhes estruturais fornecidos pelo crio-EM. O octâmero foi observado anteriormente por cristalografia de raios-X, mas foi pensado para ser simplesmente um artefato de medição. Além disso, a cristalografia de raios X perde os detalhes estruturais abertos/fechados.
"A indústria agora poderá correlacionar a função da fosfocetolase com sua estrutura correta", diz Iwasaki. "Esperamos que esses insights lembrem os pesquisadores de que a cristalografia de raios-X não é necessariamente a palavra final sobre a estrutura da enzima; o crio-EM pode oferecer informações valiosas".
Os resultados deste estudo são importantes para otimizar o desempenho de uma enzima fermentativa que é útil para a realização de sínteses químicas na indústria. Ao usar insights estruturais de enzimas para maximizar o sucesso da engenharia genética, as matérias-primas podem ser produzidas para produtos farmacêuticos, plásticos e outros materiais de maneira ambientalmente sustentável.
+ Explorar mais Bactérias comedoras de metano convertem gases de efeito estufa em combustível
