Produzir amônia por meio de processos eletroquímicos pode reduzir as emissões de dióxido de carbono
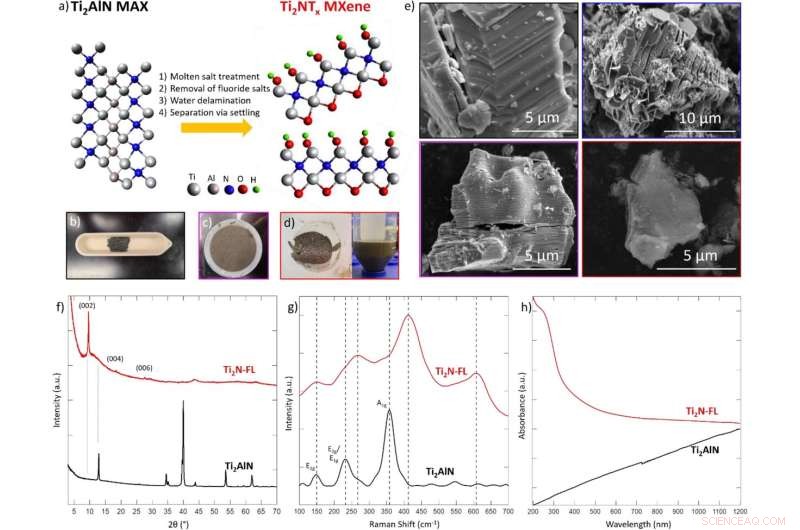
(a) Ilustração esquemática da síntese de Ti2NTx MXene via tratamento de fluoreto de sal fundido assistido por oxigênio da fase MAX principal Ti2AlN a 550 °C por 5 h sob fluxo de argônio, depois exposição ao ar, seguido de remoção de sal de fluoreto em 4 M H2SO4 , finalmente a delaminação é realizada por meio de sonicação em água por 4 h. Os modelos não são baseados em dados coletados, apenas como uma diretriz geral. Em fotografias de laboratório de (b) fase MAX, (c) Multilayer Ti2N MXene após lavagem com ácido e (d) Single layer MXene adquirido após delaminação em água. (e) Imagens SEM da fase Ti2AlN MAX (contorno preto), fase MAX tratada com sal fundido (contorno azul), Ti2N MXene multicamada (contorno roxo) e poucas camadas Ti2N MXene (contorno vermelho). O tamanho lateral dos flocos de MXene individuais é de aproximadamente 5 μm. (f) XRD, (g) Raman, e (h) espectros UV-Vis da fase Ti2AlN MAX (preto) e camada única Ti2N MXene (vermelho). A DRX foi coletada usando uma placa de silício de difração zero com um poço. A espectroscopia Raman foi coletada usando laser de 532 nm a 5% de potência em um tempo de exposição de 1 s. A espectroscopia UV-Vis foi coletada usando água como matriz. Crédito:Relatórios Científicos (2022). DOI:10.1038/s41598-021-04640-7
A amônia é comumente usada em fertilizantes porque possui o maior teor de nitrogênio dos fertilizantes comerciais, tornando-se essencial para a produção agrícola. No entanto, duas moléculas de dióxido de carbono são feitas para cada molécula de amônia produzida, contribuindo para o excesso de dióxido de carbono na atmosfera.
Uma equipe do Departamento de Engenharia Química Artie McFerrin da Texas A&M University composta pelo Dr. Abdoulaye Djire, professor assistente e estudante de pós-graduação Denis Johnson, desenvolveu um método para produzir amônia por meio de processos eletroquímicos, ajudando a reduzir as emissões de carbono. Esta pesquisa visa substituir o processo termoquímico Haber-Bosch por um processo eletroquímico mais sustentável e seguro para o meio ambiente.
Os pesquisadores publicaram recentemente suas descobertas em
Relatórios Científicos .
Desde o início de 1900, o processo Haber-Bosch tem sido usado para produzir amônia. Este processo funciona reagindo nitrogênio atmosférico com gás hidrogênio. Uma desvantagem do processo Haber-Bosch é que ele requer alta pressão e alta temperatura, deixando uma grande pegada de energia. O método também requer matéria-prima de hidrogênio, que é derivada de recursos não renováveis. Não é sustentável e tem implicações negativas no meio ambiente, acelerando a necessidade de novos processos ecologicamente corretos.
Os pesquisadores propuseram usar a reação eletroquímica de redução de nitrogênio (NRR) para produzir amônia a partir de nitrogênio atmosférico e água. Os benefícios de usar um método eletroquímico incluem o uso de água para fornecer prótons e a capacidade de produzir amônia à temperatura e pressão ambiente. Este processo exigiria potencialmente menores quantidades de energia e seria menos dispendioso e mais ecológico do que o processo Haber-Bosch.
O NRR funciona usando um eletrocatalisador. Para que esse processo seja bem-sucedido, o nitrogênio deve se ligar à superfície e se separar para produzir amônia. Neste estudo, os pesquisadores usaram MXene, um nitreto de titânio, como eletrocatalisador. O que diferencia esse catalisador dos demais é que o nitrogênio já está em sua estrutura, permitindo uma formulação de amônia mais eficiente.
"É mais fácil para a amônia se formar porque os prótons podem se ligar ao nitrogênio na estrutura, formar a amônia e então a amônia sairá da estrutura", disse Johnson. "Um buraco é feito na estrutura que pode puxar o gás nitrogênio e separar a ligação tripla."
Os pesquisadores descobriram que o uso de nitreto de titânio induz um mecanismo Mars-van Krevelen, um mecanismo popular para a oxidação de hidrocarbonetos. Este mecanismo segue um caminho de menor energia que permitiria maiores taxas de produção de amônia e seletividade por causa do nitrogênio do catalisador de nitreto de titânio.
Sem modificações nos materiais, os pesquisadores chegaram a uma seletividade de 20%, que é a relação entre o produto desejado formado e o produto indesejado formado. Seu método poderia potencialmente atingir uma maior porcentagem de seletividade com modificações, forjando um novo caminho para a produção de amônia por meio de processos eletroquímicos.
"O Departamento de Energia estabeleceu uma meta de seletividade de 60%, que é um número difícil de alcançar", disse Johnson. "Conseguimos chegar a 20% usando nosso material, mostrando um método que podemos aproveitar para avançar. Se atualizarmos nosso material, podemos chegar a 60% em breve? Essa é a questão que continuaremos trabalhando para responda."
Esta pesquisa poderia potencialmente reduzir a pegada de carbono e o uso global de energia em uma escala maior.
"No futuro, isso pode ser uma grande reforma científica", disse Djire. "Cerca de 2% da energia total do mundo é usada para a produção de amônia. Reduzir esse grande número reduziria drasticamente nossa pegada de carbono e consumo de energia."
Outros colaboradores da publicação são Eric Kelley, do departamento de engenharia química da Texas A&M, Brock Hunter, da Auburn University, e Jevaun Christie e Cullan King, da Prairie View A&M University.
+ Explorar mais A nova alquimia da neutralidade de carbono:transformando água em amônia com apenas energia renovável
