
Os pesquisadores produziram imagens coloridas em placas de cultura usando vermelho, verde, e luzes azuis para controlar o pigmento produzido por bactérias com "visão multicolor". A cor da imagem foi corrigida no Photoshop para melhorar o contraste. Crédito:Felix Moser
Os pesquisadores do MIT desenvolveram bactérias com "visão multicolor" - E. coli que reconhecem o vermelho, verde, ou luz azul (RGB) e, em resposta a cada cor, expressam diferentes genes que desempenham diferentes funções biológicas.
Para mostrar a tecnologia, os pesquisadores produziram várias imagens coloridas em placas de cultura - uma das quais significa "MIT" - usando luzes RGB para controlar o pigmento produzido pela bactéria. Fora do laboratório, a tecnologia também pode ser útil para fins comerciais, farmacêutico, e outros aplicativos.
A E. coli é programada com um sistema baseado em proteínas e enzimas, análogo a um chip de computador, com vários módulos diferentes para processar a entrada de luz e produzir uma saída biológica. Em termos de computação, uma "matriz de sensores" primeiro é ativada na presença de qualquer vermelho, verde, ou luz azul, e um "circuito" processa o sinal. Então, um "alocador de recursos" conecta a informação processada a "atuadores" que implementam a função biológica correspondente.
Pense na nova E. coli como marionetes microbianas, com luz colorida em vez de fios de marionete, fazendo com que a bactéria atue de uma certa maneira, diz o professor de engenharia biológica do MIT Chris Voigt, co-autor de um artigo na Nature descrevendo a tecnologia. "Usando cores diferentes, podemos controlar diferentes genes que estão sendo expressos, " ele diz.
Os co-autores do artigo são o ex-pós-doutorado Jesus Fernandez-Rodriguez, Felix Moser, e Miryoung Song.
A inovação da biologia sintética vem junto
Em 2005, Voigt, que co-dirige o Centro de Biologia Sintética do MIT, e outros pesquisadores foram os pioneiros em uma "câmera bacteriana" programando um sensor de luz em uma cepa de E. coli, junto com um gene que produziu o pigmento preto. Quando a luz brilhou através de um estêncil em uma placa revestida de bactérias, os micróbios formaram imagens em preto e branco. No momento, essa façanha exigia apenas quatro genes e três promotores - regiões do DNA que iniciam a transcrição do gene - para fazer o trabalho.
Novas ferramentas de biologia sintética, como o sistema de edição de genoma CRISPR, surgiram desde então, abrindo possibilidades mais amplas para os pesquisadores. Em contraste com o sistema de 2005, o novo sistema RGB - o primeiro a usar três cores - consiste em 18 genes e 14 promotores, entre outras partes, bem como 46, 000 pares de bases de DNA.
Mas com maior complexidade vêm maiores desafios. Como os pesquisadores estavam lidando com uma matriz de sensores que poderia detectar três cores diferentes, por exemplo, eles tiveram que incluir no programa microbiano uma proteína que impede a transcrição do gene dos dois sensores não utilizados.
Em termos de computação, isso é chamado de "NÃO portão, "um circuito que produz um sinal de saída - neste caso, repressão genética - somente quando não há um sinal em sua entrada. Com bactérias sob uma luz vermelha, por exemplo, a porta NOT desencadearia essa proteína repressora de genes nos sensores verde e azul, desligando-os.
Cerca de cinco anos atrás, Voigt liderou uma equipe que projetou micróbios para responder à luz vermelha e verde. Adicionar um terceiro sensor foi um grande desafio da nova pesquisa. "Dentro da célula, todos os novos sensores de proteína que você adiciona interferem uns com os outros, porque são todas as moléculas batendo em torno da célula, e todos eles exigem manter a célula viva e feliz. Com cada sensor adicional que você adicionar, que fica exponencialmente mais difícil, " ele diz.
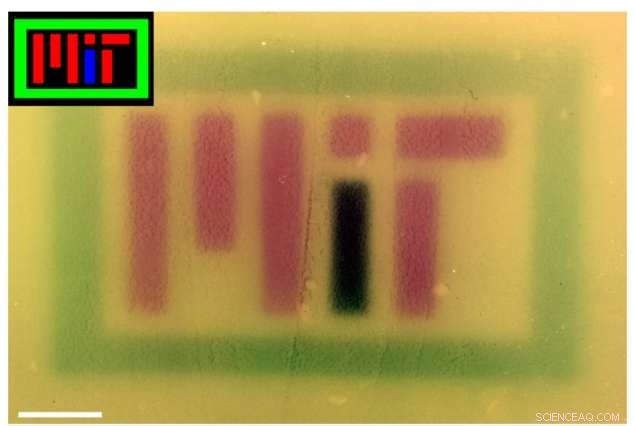
Imagens coloridas (inserções) foram projetadas em placas de bactérias contendo o sistema RGB para soletrar "MIT". A cor da imagem foi corrigida no Photoshop para melhorar o contraste. Crédito:Felix Moser
A esse respeito, Voigt acrescenta, o alocador de recursos do sistema, um novo recurso, também atua como um disjuntor, desligando os sensores se todos os três ligarem ao mesmo tempo, sobrecarregando a célula.
Do ponto de vista da engenharia genética, a configuração de quatro subsistemas foi "o maior impacto deste trabalho, "Voigt diz. Cada subsistema - a matriz de sensores, circuitos, atuadores de recursos, e atuadores - foi projetado, construído, e otimizado isoladamente antes de ser montado em uma estrutura final. Isso simplificado, processo modular pode abrir caminho para uma programação biológica mais complexa no futuro, de acordo com os pesquisadores.
De um modo geral, Voigt vê o novo sistema como o culminar de uma década de inovações da biologia sintética. “É uma representação de onde estamos atualmente, e todas as peças que precisaram ser reunidas na última década para criar sistemas dessa escala e complexidade, " ele diz.
Fazendo "bactérias disco"
Para fazer as novas imagens coloridas, os pesquisadores programaram a bactéria para produzir o mesmo pigmento que o vermelho, verde, ou luz azul brilhou sobre eles. Em uma incubadora, os pesquisadores revestiram uma placa de Petri com bactérias geneticamente idênticas. "Você pode pensar nisso como um filme não revelado, onde você tem a placa de Petri com bactérias, "Voigt diz, "e a câmera é a incubadora."
No topo da incubadora há um orifício, onde uma imagem estêncil é projetada na placa. Hora extra, as bactérias crescem, produzindo uma enzima que produz um pigmento correspondente a qualquer cor RBG pela qual eles são iluminados. Além do logotipo do MIT, os pesquisadores produziram imagens de vários padrões, fruta multicolorida, e o personagem de videogame Super Mario.
As bactérias modificadas também podem ser usadas para iniciar e interromper rapidamente as reações químicas de micróbios em processos de fermentação industrial, que são usados para fazer produtos farmacêuticos e outros produtos. Hoje, controlar tais reações químicas requer despejar diferentes aditivos químicos em grandes tonéis de fermentação, o que é demorado e ineficiente.
Em seu jornal, os pesquisadores demonstraram esse conceito de "produtos químicos sob demanda" em pequena escala. Usando ferramentas de edição de genes CRISPR, eles modificaram três genes que produzem acetato - um subproduto às vezes indesejado de vários bioprocessos - para produzir menos da substância química em resposta às luzes RGB.
"Individualmente, e em combinação um com o outro, as diferentes cores de luz reduzem a produção de acetato sem sacrificar o acúmulo de biomassa, "escreveram os pesquisadores em seu artigo.
Voigt cunhou um nome divertido para esses micróbios industriais. "Eu me refiro a eles como 'bactérias disco, '" ele diz, "porque luzes de cores diferentes estão piscando dentro do fermentador e controlando as células."
Um futuro aplicativo, Voigt acrescenta, poderia estar no controle de células para formar vários materiais e estruturas. Pesquisadores, incluindo alguns no MIT, começaram a programar células para formar materiais vivos que um dia poderiam ser usados para projetar células solares, materiais de autocura, ou sensores de diagnóstico.
"É incrível quando você olha para o mundo e vê todos os diferentes materiais, "Voigt diz." Coisas como celulose, proteínas de seda, metais, nanofios, e materiais vivos como órgãos - todas essas coisas diferentes na natureza que obtemos de células que crescem em padrões diferentes. Você pode imaginar o uso de diferentes cores de luz para dizer às células como elas devem crescer como parte da construção desse material. "
Esta história foi republicada por cortesia do MIT News (web.mit.edu/newsoffice/), um site popular que cobre notícias sobre pesquisas do MIT, inovação e ensino.