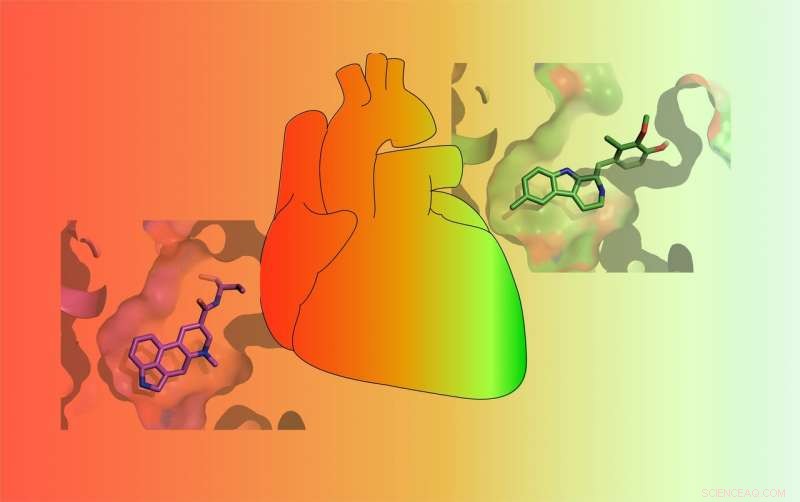
As drogas variam em sua capacidade de ativar o receptor de serotonina 5-HT2B. Alguns medicamentos (RED) ativam fortemente o receptor e causam cardiopatia valvar com risco de vida, enquanto outros o ativam apenas fracamente (VERDE) e são menos propensos a causar efeitos colaterais graves. Crédito:Roth Lab
Serotonina, conhecido como o neurotransmissor da "felicidade", é uma substância química encontrada no corpo responsável por sensações de bem-estar. Mas a serotonina não é a única substância química que se liga aos 13 receptores de serotonina encontrados na superfície das células. Longe disso. Muitos medicamentos aprovados também se ligam aos receptores de serotonina. E um desses receptores - chamado 5-HT2BR - deixou os desenvolvedores de medicamentos muito infelizes. Isso porque alguns medicamentos que tratam a doença de Parkinson, enxaquecas, tumores hipofisários, e a obesidade foi projetada para atingir outros receptores celulares, mas também ativar 5-HT2BR, levando a doença cardíaca valvar com risco de vida. Como resultado, muitos desses medicamentos foram retirados do mercado.
Agora, pela primeira vez, Cientistas da Escola de Medicina da UNC descobriram precisamente por que uma droga se liga ao 5-HT2BR e ativa o receptor para causar problemas cardíacos, enquanto drogas muito semelhantes não o fazem. Eles também descobriram por que uma terceira droga age como um antagonista de 5-HT2BR - ela bloqueia a atividade do receptor - enquanto a conhecida droga alucinógena LSD, muito conhecida, não.
Publicado em Nature Structural &Molecular Biology , esta pesquisa fornece aos desenvolvedores de drogas uma visão muito necessária sobre este receptor de serotonina e outros semelhantes.
"Por muito tempo, precisamos saber precisamente como esse receptor e outros se ligam a vários compostos se quisermos desenvolver medicamentos mais seguros e eficazes, "disse o autor sênior Bryan L. Roth, MD, Ph.D., o Professor Distinto Michael Hooker de Proteína Terapêutica e Proteômica Translacional no Departamento de Farmacologia. "Resolver as estruturas cristalinas desses receptores de serotonina ligados a vários compostos é o primeiro passo essencial para criar medicamentos melhores, não apenas para as condições acima mencionadas, mas para muitas outras, incluindo esquizofrenia, ansiedade, e depressão. "
Em experimentos liderados por John McCorvy, Ph.D., que era pós-doutorado no laboratório Roth durante esta pesquisa, os cientistas induziram meticulosamente os receptores a se condensarem em uma estrutura de cristal compacta, enquanto os receptores estavam ligados a uma droga. Em seguida, eles dispararam raios-X no cristal para calcular a estrutura do receptor a partir dos padrões de difração resultantes. McCorvy e colegas fizeram isso várias vezes para cristalizar os receptores de serotonina ligados a vários compostos diferentes, que tinha sido impossível por décadas porque os receptores são proteínas notoriamente inconstantes - pequenas, frágil, e normalmente em movimento enquanto se ligam a compostos.
Os cientistas então usaram outras técnicas experimentais descritas no artigo para mostrar precisamente como cada droga ativou ou não ativou o receptor.
Em um conjunto de experimentos, McCorvy e colegas mostraram que a metilergonovina - o ingrediente ativo em um medicamento para enxaqueca - se liga a uma região específica de 5-HT2BR e a ativa. A metilergonovina é um agonista. Mas seu composto pai, metisergida, não ativa o receptor, tornando-o um antagonista. O laboratório de Roth descobriu que a diferença entre as duas drogas é apenas um átomo de carbono e alguns átomos de hidrogênio. Juntos, eles são chamados de metil. Esse minúsculo metil acaba sendo o culpado pelos problemas das válvulas cardíacas relacionados ao 5-HT2BR.
Em um segundo conjunto de experimentos, eles mostraram por que a droga lisurida de Parkinson não ativa o 5-HT2BR, mas o LSD sim. A diferença no local de ligação é apenas um único átomo de nitrogênio e estereoquímica - essencialmente o espaço entre a droga e o receptor que desempenha um papel na precisão com que qualquer droga pode se encaixar no receptor para desencadear ou interromper a atividade celular.
Interessantemente, lisurida e LSD se ligam ao receptor de serotonina na região típica que os cientistas esperariam. Mas a química de como essas duas drogas se ligam naquele local não explica seus efeitos muito diferentes nas células e nas pessoas. McCorvy e colegas descobriram que a lisurida também está inserida em outra parte do receptor chamada de bolsa de ligação estendida, mas o contato de lisuride não é forte. O LSD, por outro lado, liga-se fortemente ao bolso de ligação estendido, fazendo do LSD um agonista muito forte - ele ativa o 5-HT2BR (assim como outros receptores). O LSD faz isso recrutando uma proteína chamada beta-arrestin2. Os cientistas chamam esse processo de "ativação da via da β-arrestina, "e tem sido implicado em vários efeitos colaterais relacionados à terapêutica.
Essas descobertas ajudarão os criadores de medicamentos a evitar a ativação de 5-HT2BR ao projetar medicamentos para direcionar outras proteínas receptoras - comumente chamadas de receptores acoplados à proteína G, ou GPCRs. Por outro lado, esta pesquisa ajudará os desenvolvedores de medicamentos que desejam inibir a ativação do 5-HT2BR para tratar doenças cardíacas valvares e outros distúrbios.
"Basicamente, cristalizando as estruturas de 5-HT2BR ligado a vários medicamentos comuns, descobrimos que não há um mecanismo pelo qual o receptor é ativado, "McCorvy disse." Existem vários. "Para criar um preciso, seguro, e medicação eficaz, os cientistas querem explorar apenas as vias celulares importantes para tratar a doença em que estão interessados. McCorvy acrescentou:"Essa é a vanguarda do desenvolvimento de medicamentos."