Pesquisadores investigam proteínas causadoras de doenças cerebrais em nível atômico
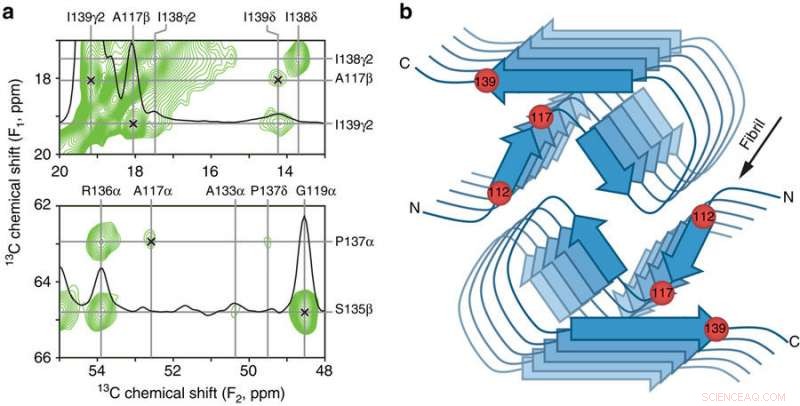 p Contatos principais entre resíduos e modelo esquemático do núcleo β amiloide PrP23-144 humano. a Pequenas regiões de um espectro de NMR de estado sólido bidimensional 13C-13C DARR de 900 MHz registrado com um tempo de mistura de 500 ms para fibrilas amilóides geradas a partir de huPrP23-144 expressas com 3-13C-piruvato como fonte de carbono. As regiões espectrais contêm as principais restrições na estrutura do núcleo [hu] amiloide na forma de correlações de longo alcance inequívocas (indicadas por marcas x) entre os seguintes átomos de 13C:A117Cβ-I139Cγ2, A117Cβ-I139Cδ, A117Cα-P137Cα, e G119Cα-S135Cβ. b Modelo esquemático para o núcleo [hu] amiloide com base na combinação de NMR de estado sólido e dados de microscopia eletrônica de transmissão de feixe inclinado (consulte o texto para obter detalhes). Neste modelo, [hu] fibrilas amiloides consistem em dois protofilamentos em um arranjo simétrico C2 com regiões de folha β correndo paralelas ao eixo longo da fibrila. As localizações aproximadas dos resíduos de aminoácidos 112, 117, e 139, que têm grande impacto na estrutura adotada pela PrP23-144 amiloide, conforme discutido no texto, são indicados por esferas vermelhas. Crédito: Nature Communications (2017). DOI:10.1038 / s41467-017-00794-z
p Contatos principais entre resíduos e modelo esquemático do núcleo β amiloide PrP23-144 humano. a Pequenas regiões de um espectro de NMR de estado sólido bidimensional 13C-13C DARR de 900 MHz registrado com um tempo de mistura de 500 ms para fibrilas amilóides geradas a partir de huPrP23-144 expressas com 3-13C-piruvato como fonte de carbono. As regiões espectrais contêm as principais restrições na estrutura do núcleo [hu] amiloide na forma de correlações de longo alcance inequívocas (indicadas por marcas x) entre os seguintes átomos de 13C:A117Cβ-I139Cγ2, A117Cβ-I139Cδ, A117Cα-P137Cα, e G119Cα-S135Cβ. b Modelo esquemático para o núcleo [hu] amiloide com base na combinação de NMR de estado sólido e dados de microscopia eletrônica de transmissão de feixe inclinado (consulte o texto para obter detalhes). Neste modelo, [hu] fibrilas amiloides consistem em dois protofilamentos em um arranjo simétrico C2 com regiões de folha β correndo paralelas ao eixo longo da fibrila. As localizações aproximadas dos resíduos de aminoácidos 112, 117, e 139, que têm grande impacto na estrutura adotada pela PrP23-144 amiloide, conforme discutido no texto, são indicados por esferas vermelhas. Crédito: Nature Communications (2017). DOI:10.1038 / s41467-017-00794-z
p Os pesquisadores que estudam uma proteína que causa uma doença degenerativa cerebral hereditária em humanos descobriram que o ser humano, formas de rato e hamster da proteína, que têm sequências de aminoácidos quase idênticas, exibem estruturas tridimensionais distintas no nível atômico. p A proteína causa angiopatia amilóide cerebral humana familiar (CAA), e o estudo, que aparece em
Nature Communications , é o primeiro a examinar as formas da proteína em três espécies diferentes.
p Christopher Jaroniec, professor de química e bioquímica da The Ohio State University, disse que as descobertas destacam o fato de que pequenas alterações em um único aminoácido podem causar profundas diferenças na estrutura e função entre esta família de proteínas.
p "As diferenças em grande escala nas estruturas e características de transmissão dessas proteínas - causadas pelo que equivale a diferenças aparentemente insignificantes nas posições de alguns átomos de carbono e hidrogênio - são bastante notáveis, "Jaroniec disse.
p O estudo não constitui a base para um novo teste ou tratamento para CAA, em vez disso, usa essas proteínas como modelos para compreender os aspectos fundamentais da transmissão entre espécies de toda uma classe de doenças cerebrais degenerativas conhecidas como doenças de príons, ele explicou. Ele também destaca a utilidade da espectroscopia de ressonância magnética nuclear (NMR) de estado sólido para a geração de imagens das estruturas de proteínas associadas a doenças por príons.
p Os pesquisadores sabem que no corpo, as moléculas de proteína associadas ao CAA formam placas que se alojam nas paredes dos vasos sanguíneos do cérebro, mas não houve exames detalhados da estrutura molecular dessas placas até recentemente. Em 2008, Pesquisadores do estado de Ohio e seus parceiros da Case Western Reserve University realizaram os estudos iniciais de estado sólido da variante de proteína príon relevante, e reduziu a lista de aminoácidos possivelmente críticos para sua função para cerca de 30.
p Agora, eles demonstraram que um único aminoácido - conhecido por seu número ao longo da cadeia protéica, 139 - é a chave para esta variante da proteína príon que adota uma estrutura "semelhante à humana" versus uma estrutura "semelhante à do hamster", enquanto outro aminoácido, 112, governa as diferenças estruturais entre as versões humana e de camundongo da proteína. Eles também mostraram que esses dois aminoácidos parecem ser responsáveis pelo surgimento de "cepas de príons" estruturalmente distintas dentro da mesma sequência de proteína, em analogia a cepas distintas de um vírus.
p As doenças de príon mais conhecidas incluem a encefalopatia espongiforme bovina (freqüentemente chamada de "doença da vaca louca") e a doença de Creutzfeldt-Jakob em humanos. Todos são incuráveis e fatais, e alguns também podem ser transmissíveis. As estruturas adotadas pelas proteínas príon do cérebro nas placas são consideradas críticas para sua capacidade de transmissão entre diferentes hospedeiros e de causar doenças.
p "Nosso grupo está trabalhando atualmente na determinação das estruturas moleculares de alta resolução das variantes da proteína príon truncada associadas ao CAA humano familiar, a fim de obter uma compreensão atomística completa dos fatores subjacentes à sua transmissão, e o presente estudo é um passo importante neste esforço, "Jaroniec disse.
p “Esperamos que um dia nosso grupo e outros pesquisadores possam usar metodologias semelhantes para desvendar a base estrutural das doenças príon transmissíveis, " ele adicionou.
