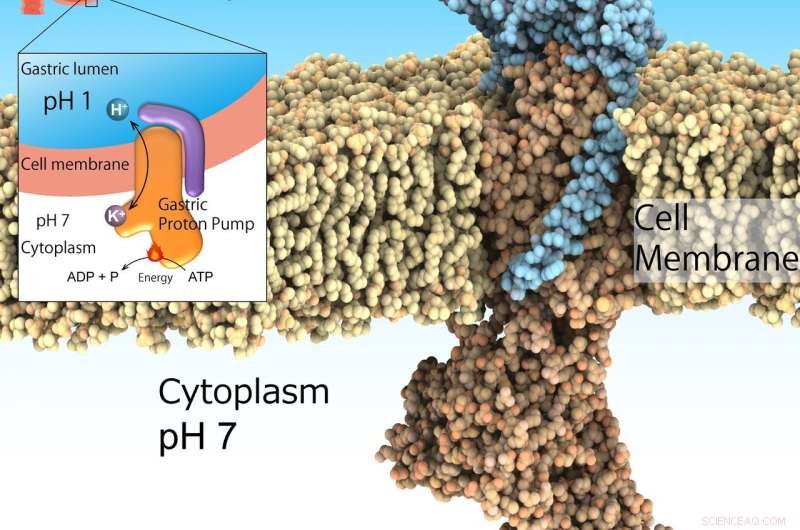
A bomba de prótons gástrica, também conhecido como H +, K + -ATPase, é expresso na superfície do estômago para secretar o ácido gástrico indispensável para a digestão das proteínas dos alimentos. Contudo, muita secreção de ácido induz úlceras. A bomba de prótons gástrica absorve prótons do citoplasma neutro (pH 7) para o meio ácido do estômago (pH 1) impulsionado pelo ATP como fonte de energia. Assim, é um importante alvo de drogas para doenças relacionadas ao ácido. Crédito:Kazuhiro Abe
O ambiente altamente ácido do estômago é essencial para a digestão. Além disso, atua como uma barreira importante para patógenos invasivos. Contudo, A acidificação excessiva do estômago leva a úlceras. Embora esta não seja uma condição de risco de vida, pode prejudicar consideravelmente a saúde dos indivíduos afetados. A supressão de ácido em combinação com antibióticos é o tratamento reconhecido para erradicar a bactéria Helicobacter pylori, um fator de risco para câncer gástrico. Este ambiente de pH1 é regulado pelo H gástrico + , K + -ATPase, uma classe de enzimas que catalisam H + transporte da solução citosólica neutra (pH 7) para o lúmen gástrico ácido (pH 1) alimentado pela fonte de energia celular ATP. Portanto, H gástrico + , K + -ATPase é um alvo importante para medicamentos que tratam o excesso de secreção de ácido estomacal.
A principal questão de pesquisa nesta área de estudo é como um ambiente altamente ácido pode ser alcançado no estômago. Para resolver esta questão, os pesquisadores buscaram a estrutura de H + , K + -ATPase. A equipe publicou recentemente suas descobertas em Natureza .
"Em nosso estudo, usamos cristalografia de raios-X para determinar as estruturas do H gástrico + , K + -ATPase ligada a dois inibidores da bomba de prótons, vonoprazan e SCH28080, O primeiro autor, Kazuhiro Abe, explica. "Esta informação é importante tanto para o refinamento dos medicamentos existentes quanto para a descoberta de novos medicamentos."
A cristalografia de raios-X é uma técnica que usa padrões de difração de raios-X para determinar alta resolução, estruturas tridimensionais de moléculas, como proteínas, pequenas moléculas orgânicas, e materiais.
A equipe resolveu com sucesso a estrutura cristalina de H + , K + -ATPase em complexo com vonoprazan ou SCH28080 para uma resolução de 2,8 Å - alta o suficiente para revelar que as drogas parcialmente se sobrepõem, mas tinham modos de ligação claramente distintos em seus locais de ligação encontrados no meio de um conduto que vai do lúmen gástrico ao cátion -local de ligação.
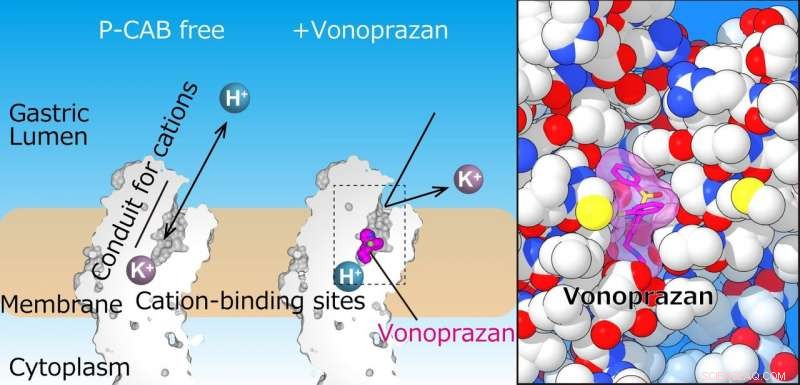
A bomba de prótons gástrica exporta H + para o lúmen gástrico, que segue a captação de K + no citoplasma. O painel esquerdo mostra fatias do domínio transmembrana da bomba de prótons gástrica. Na estrutura atual, P-CAB (vonoprazan, magenta) se liga no meio da via de transporte de cátions (conduíte), que bloqueia o transporte de cátions. A visão ampliada do local de ligação do vonoprazan (magenta) revela sua forte ligação à proteína (direita). Crédito:Kazuhiro Abe
"As estruturas cristalinas sugerem que a configuração firme no local de ligação de cátions reduz o valor de pKa (uma medida da força do ácido) do ácido glutâmico no resíduo 820 o suficiente para permitir a liberação de um próton mesmo no ambiente de pH 1 do estômago, "O autor sênior Yoshinori Fujiyoshi diz." Essas estruturas definem a interação molecular entre os P-CABs (K + -bloqueadores de ácido competitivos) e H + , K + -ATPase, e revelar como H + , K + -ATPase expele H + no estômago, mesmo em pH1. Essas informações contribuirão significativamente para a base de conhecimento para a descoberta de medicamentos para condições relacionadas à acidificação excessiva do estômago. "
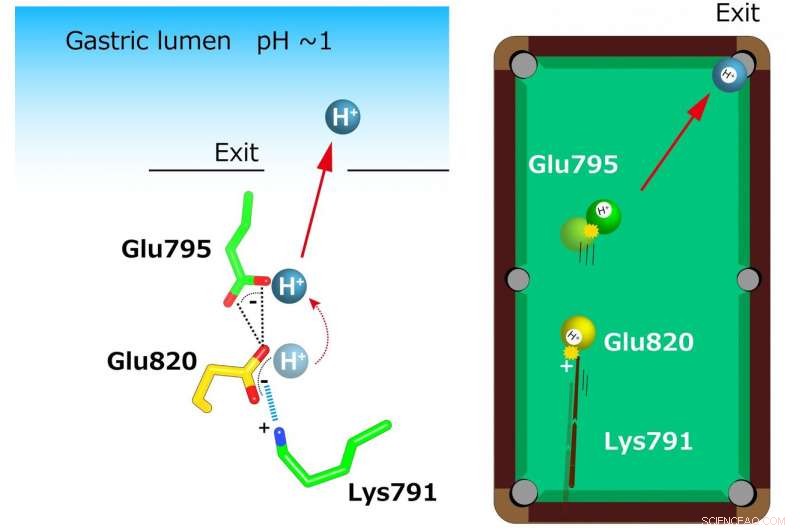
A coordenação incomumente estreita de dois glutamatos (Glu795 e Glu820) e uma lisina (Lys791) no local de ligação do cátion foi revelada na estrutura cristalina. Um único H + ligado a Glu820 é extrudado pela carga positiva de Lys791, mesmo para o lúmen gástrico altamente ácido (à esquerda). Este mecanismo é comparado a um modelo de bilhar (direita). Uma carga positiva no resíduo de lisina atua como um "sinal" que atira a "bola amarela" (H +) em Glu820. Esta bola amarela, por sua vez, atinge outro H + (bola verde) em Glu795, que é exposta à via de transporte de cátions. Finalmente, uma única bola (H +) está na bolsa (saída para o lúmen gástrico). Crédito:Kazuhiro Abe