Crédito:North Carolina State University
Pesquisadores da North Carolina State University modelaram e analisaram os modos de ligação de 210 moléculas anteriormente relatadas como inibidoras da função de uma família de enzimas envolvidas na regulação do sal e da pressão arterial no corpo humano. Suas descobertas podem ajudar os pesquisadores a entender melhor as relações complexas entre a regulação do sal, hipertensão e pressão alta.
A família de enzimas With-No-Lysine (WNK) é um grupo de quatro proteínas que estão envolvidas na regulação da pressão arterial e dos fluidos corporais. Essas enzimas estão associadas a uma forma rara e grave de hipertensão; Contudo, suas funções individuais não são bem compreendidas. Para compreender melhor o papel de cada enzima, os pesquisadores precisam desenvolver moléculas-alvo que possam desligar seletivamente suas funções. As moléculas atualmente em uso se ligam a todas as quatro proteínas WNK, evitando que os pesquisadores descubram as diferenças de função entre cada um.
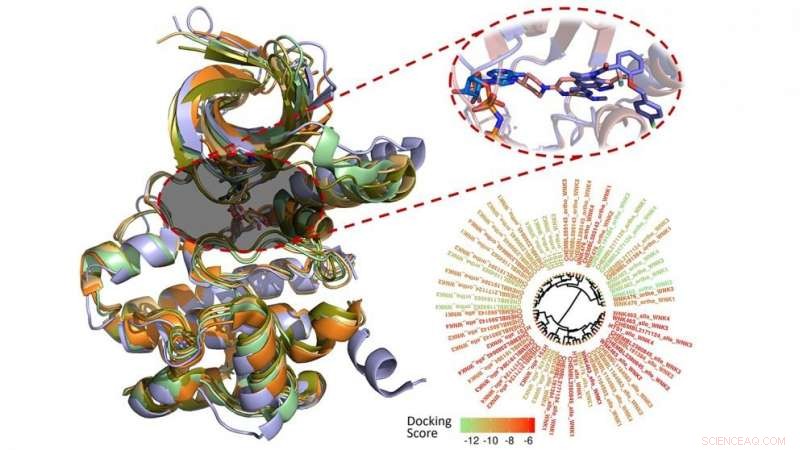
Denis Fourches, professor assistente de química computacional, e a pesquisadora de pós-doutorado Melaine Kuenemann usou modelagem de computador para caracterizar, analisar e visualizar cada uma das 210 moléculas conhecidas por se ligar à família WNK.
Fourches e Kuenemann criaram modelos 3-D de todos os 210 compostos e os encaixaram na bolsa de ligação de cada enzima WNK. Então, eles mediram o quão bem os compostos realmente se ligaram e analisaram suas interações específicas dentro dos quatro diferentes bolsões de ligação. Eles ainda realizaram simulações de dinâmica molecular em tempo real para estudar como essas interações variavam ao longo do tempo, revelando novas maneiras de tornar as moléculas mais seletivas para uma enzima WNK específica.
"Não há muitos compostos conhecidos por inibir a família WNK quinase, e os que temos se ligam a todas as quatro enzimas, "Fourches diz." Se quisermos entender melhor as conexões entre essas proteínas e hipertensão, precisamos identificar produtos químicos que podem desligar uma quinase WNK por vez e, assim, interrogar melhor sua função individual.
"Este é o primeiro estudo que tenta olhar para o 'quadro geral' para esses inibidores WNK usando simulações de computador de última geração. Esperamos que nossas descobertas ajudem os químicos medicinais e outros pesquisadores a projetar novas moléculas com maior ligação potência e seletividade em relação a cada quinase WNK individual. "
O trabalho aparece em Informática Molecular .