Os pesquisadores estudam os meandros da recombinação homóloga e das pontes cromossômicas anormais
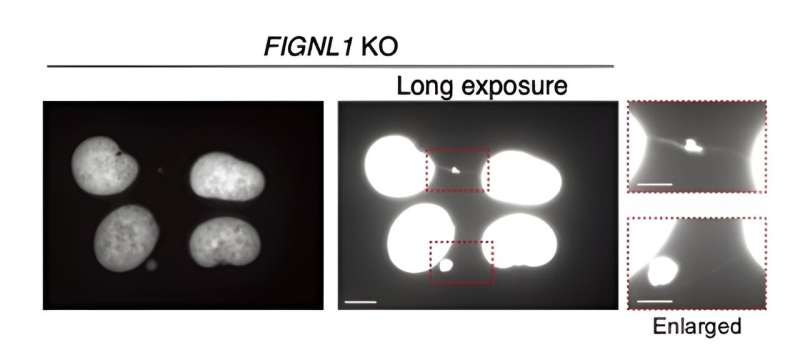 As imagens representativas do microscópio acima mostram pontes ultrafinas, um tipo de ligação anormal entre os cromossomos que causa instabilidade genética catastrófica. Estas pontes, compostas por ADN emaranhado, foram observadas em células humanas sem FIGNL1, cimentando o seu papel na regulação adequada do RAD51. Crédito:Professor Miki Shinoara da Universidade Kindai
As imagens representativas do microscópio acima mostram pontes ultrafinas, um tipo de ligação anormal entre os cromossomos que causa instabilidade genética catastrófica. Estas pontes, compostas por ADN emaranhado, foram observadas em células humanas sem FIGNL1, cimentando o seu papel na regulação adequada do RAD51. Crédito:Professor Miki Shinoara da Universidade Kindai Manter intacta a informação genética armazenada no DNA genômico durante o ciclo de divisão celular é crucial para quase todas as formas de vida. Danos extensos no DNA invariavelmente causam vários rearranjos genômicos adversos, que podem levar à morte celular nos melhores casos e à ocorrência de doenças como o câncer nos piores casos.
Felizmente, as células em todos os três domínios da vida partilham um mecanismo peculiar e livre de erros para manter a informação genética, conhecido como recombinação homóloga (HR).
O processo de HR começa quando uma célula encontra danos no DNA durante ou posteriormente a síntese do DNA, iniciando uma cascata de eventos. O DNA danificado é primeiro ressecado ou cortado para criar extremidades de fita simples próximas ao local danificado. Essas extremidades são então combinadas com sua região correspondente em um cromossomo replicado disponível, também conhecido como “cromátide irmã”, que é essencialmente usado como modelo para reparar o DNA danificado.
Como seria de esperar, a via da FC envolve uma miríade de proteínas e maquinaria celular. Embora a maioria dessas proteínas e maquinaria celular sejam bem estudadas, algumas delas permanecem um tanto enigmáticas. É o caso dos reguladores da RAD51, proteína responsável por reparar quebras na cadeia dupla do DNA.
Normalmente, o RAD51 forma filamentos que ajudam a preservar as forquilhas de replicação do DNA – arranjos transitórios de DNA que ocorrem frequentemente durante a replicação do DNA, como no colapso da forquilha de replicação. A regulação adequada do RAD51, bem como a degradação desses filamentos após sua finalidade ter sido cumprida, é essencial para a RH.
No entanto, os mecanismos precisos pelos quais a acumulação anormal de RAD51 leva à instabilidade genética não são completamente compreendidos, e muitos reguladores positivos e negativos de RAD51 permanecem obscuros.
Agora, porém, em um artigo recente publicado na Nucleic Acid Research em 10 de abril de 2024, uma equipe de pesquisa liderada pelo professor Miki Shinoara do Departamento de Biociências Avançada da Universidade Kindai, Japão, investigou a estreita relação entre RAD51 e FIGNL1, um de seus principais reguladores. O estudo foi coautor de Kenichiro Matsuzaki, também do Departamento de Biociência Avançada da Universidade Kindai, e lança uma luz muito necessária sobre as complexidades do processo de RH.
Primeiro, os pesquisadores modificaram geneticamente células humanas que não expressavam FIGNL1 (isto é, células FIGNL1 KO), usando o método CRISPR/Cas9 bem estabelecido. Então, usando técnicas avançadas de imunocoloração envolvendo anticorpos cuidadosamente selecionados e microscopia de fluorescência, eles visualizaram detalhadamente o processo de RH, procurando indicadores de anormalidades.
Ao combinar esta abordagem com uma infinidade de outros procedimentos experimentais, como western blotting, análise do ciclo celular, ensaios de proteínas e análises genômicas e transcriptômicas, eles conseguiram obter uma imagem abrangente do que acontece em uma célula quando a FIGNL1 está faltando.
Os resultados revelam que a FIGNL1 é uma enzima de desmontagem de RAD51 altamente especializada que é necessária para a separação adequada dos cromossomos após a “desmontagem” dos garfos de replicação.
Mais especificamente, quando os filamentos RAD51 não são totalmente desmantelados, ocorrem eventos anormais durante a mitose que produzem intermediários não resolvidos. Em última análise, isso leva à formação das chamadas “pontes cromossômicas” entre as cromátides irmãs. Estas estruturas ultrafinas são muito prejudiciais ao funcionamento normal da célula, causando a propagação de informação genética catastrófica.
Compreender os detalhes mais sutis do percurso do RH, os seus principais intervenientes e os seus muitos subprocessos é extremamente importante não apenas do ponto de vista biológico, mas também do ponto de vista médico.
“A morte celular devido à desregulação da FC é um mecanismo importante pelo qual os medicamentos anticâncer exibem citotoxicidade específica das células cancerígenas”, explica o Prof. Shinohara. “Até agora, o principal alvo tem sido a deficiência de ativação da FC, mas os resultados deste estudo mostram que a ativação persistente do RAD51 também apresenta citotoxicidade e pode ser um alvo molecular para medicamentos anticâncer”.
Além disso, a maquinaria celular envolvida na via da RH pode ser aproveitada como uma poderosa ferramenta de bioengenharia.
"HR é um sistema bem conservado entre a maioria das espécies e também está intimamente conectado a tecnologias de modificação genética, como edição de genoma e tecnologias de direcionamento de genes", comenta o Prof. Shinohara, "Assim, elucidando os mecanismos que controlam a atividade da recombinase, como aquela do RAD51, pode contribuir para aumentar a eficiência das técnicas de modificação genética”.
Vale a pena notar que a engenharia genética é um caminho altamente eficaz para aumentar o rendimento das colheitas e para personalizar organismos microbianos para tarefas como a biorremediação, que aborda vários problemas do mundo moderno.
No geral, as descobertas deste estudo não apenas lançam luz sobre um processo biológico universal, mas também abrem caminho para uma melhor compreensão dos mecanismos celulares para importantes descobertas de medicamentos e progresso no campo da engenharia genética.
