 p Estrutura respiratória megacomplexa. Crédito: Célula (2017). DOI:10.1016 / j.cell.2017.07.050
p Estrutura respiratória megacomplexa. Crédito: Célula (2017). DOI:10.1016 / j.cell.2017.07.050
p (Phys.org) - peça por peça, o diagrama do circuito para o transporte de elétrons na mitocôndria está mais perto da conclusão. Cada nova estrutura obtida para qualquer um dos cinco complexos respiratórios restringe ainda mais o quebra-cabeça montado. Eventualmente, grandes blocos são organizados em suas colocações finais. A composição exata do maior bloco, o chamado megacomplex, há muito tempo ilude os pesquisadores. Agora, após a imagem de 140 subunidades individuais com resolução de 3,9 anstrom, o Full Monty foi desnudado. Pesquisadores descrevem em
Célula exatamente como o megacomplexo respiratório humano é montado e parece funcionar. p Longe vão os dias simples. Não há mais diagramas grosseiros com complexos alinhados na membrana de um a cinco, com elétrons e seus portadores móveis viajando sequencialmente da esquerda para a direita. Traga a estequiometria, e traga o 2-D. Estequiometria significa que, na realidade, cada complexo é realmente representado no megacomplex em um número de cópia específico. Essas cópias extras precisam ir a algum lugar em qualquer representação precisa. Não apenas isso, mas os portadores de elétrons menores precisam de um espaço para se pendurar. Eles também precisam estar presentes nos canais que permanecem locais para o megacomplex ou possivelmente se difundem para outros. A geometria final ditará onde caminhos separados de elétrons se fundem ou se bifurcam, e onde eles têm maior probabilidade de rodar ao contrário.
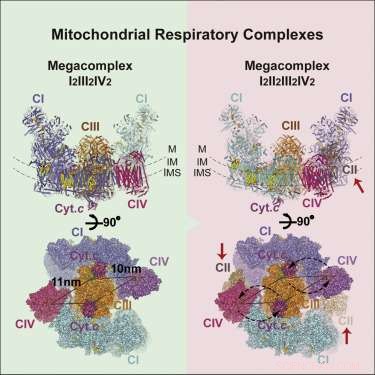
p A imagem do megacomplexo (MC) que surgiu tem a seguinte estequiometria:MCI2II2III2IV2. Isso significa que os complexos I, II, III, E IV estão presentes em duplicata, enquanto o complexo V está ausente. Ele é configurado dentro da membrana em uma estrutura circular com o CIII dimérico localizado no centro e alimentado por complexos CI e CIV periféricos. Os complexos CII aparentemente não são requisitos essenciais para a estrutura central, mas, ao contrário, são teorizados para serem encaixados em lacunas conforme necessário. Os autores também encontraram evidências de uma versão leve do megacomplex que às vezes pode ser montado com apenas um único complexo de CI.
p O posicionamento central do dímero CIV sugere uma certa lógica. CIV, ou citocromo oxidase, é o terminal de aterramento para os elétrons que entram na cadeia. Aqueles que chegaram até aqui foram rebaixados na hierarquia do potencial de redução, tanto quanto podem. Aqui, eles são imersos em moléculas de oxigênio em espera, que se exaurem como moléculas de água. Elétrons de alto potencial empacotados como NADH entram no complexo em seu perímetro e são canalizados para o centro. A ausência de complexos C5 pode não ser tão incomum, considerando que eles são tipicamente encontrados como fileiras de dímeros em forma de "V" que contorcem a membrana em regiões de alta curvatura nas curvas na cristea.
p Com a estrutura básica em mãos, os pesquisadores foram capazes de sugerir alguns princípios básicos de operação. Sua inclusão e colocação de CII explicam efetivamente o transporte reverso de elétrons do succinato para o NADH. A geometria proposta também cria um Q-pool selado (um portador de elétrons solúvel em lipídios) que é acessível tanto para CI quanto para CII. Os autores também foram capazes de identificar a identidade e as localizações de várias moléculas de lipídios que protegem o complexo dentro da membrana, especificamente, várias moléculas essenciais de fosfatidiletanolamina, fosfatidilcolina, e cardiolipina. Eles também foram capazes de identificar as vias de transferência de elétrons preferidas ou mais eficientes, o que, por sua vez, restringe quantos elétrons podem ser transferidos simultaneamente entre os portadores ativos.
p Entre os benefícios imediatos deste novo trabalho está que muitas das mutações patogênicas anteriormente não completamente compreendidas em proteínas respiratórias agora fazem sentido. Antes de ter qualquer estrutura megacomplex, os pesquisadores não tiveram escolha a não ser se concentrar em como as mutações afetam a estrutura ou função dos complexos individuais. Acontece que a maioria das mutações registradas nas subunidades principais Ci e alvo CIII estão em resíduos envolvidos em sítios de interação proteína-proteína entre complexos. (Por exemplo, mutações associadas à doença em subunidades NDUFV1, NDUFS1, ND1, ND5, e ND6 em CI e subunidade MT-CYB em CIII). Isso mostra a futilidade de tentar olhar apenas para proteínas e subunidades individuais na ausência de uma visão geral.
p Deve-se mencionar que os esforços anteriores para definir a estequiometria do complexo respiratório obtiveram resultados ligeiramente diferentes dependendo de quais órgãos e espécies foram estudados. Batata, vaca, ovelha, e fermento, que nem sempre tem um complexo de CI para falar, todos foram estudados. Não é surpreendente que circunstâncias diferentes possam exigir estequiometria e formas diferentes. Diferentes estruturas megacomplexas implicariam em diferentes vantagens para canalização de substrato, intensificação catalítica, sequestro de intermediários reativos, ou estabilização estrutural. Um estudo que analisou especificamente as mitocôndrias do coração estabeleceu a proporção para os complexos de fosforilação oxidativos I:II:III:IV:V como 1:1,5:3:6:3. Nesse caso, os autores chamam seu complexo de "respirasome".
p Com o megacomplexo respiratório agora presumivelmente rachado, o próximo grande passo à frente é colocar algumas das outras superestruturas do sistema de membrana dupla mitocondrial em modelos para prever por que a cristea tem a aparência que tem. Os enormes complexos de importação TIM-TOM abrangem ambas as membranas e estão intimamente associados aos mitocondriais que traduzem as proteínas mitocondriais. Os mitorribossomos, por sua vez, estão localizados em nucleoides associados à membrana subjacentes que abrigam cópias do mtDNA. Por analogia ao nucléolo do núcleo, essa estrutura composta de nucleóide-ribossomo foi denominada 'mitocondríolo ". Outros complexos importantes estão na mistura de participantes que disputam o estado crítico da membrana. O lançador malato-aspartato, por exemplo, é o vaivém mais importante do cérebro e equilibra os principais metabólitos entre as mitocôndrias e o citosol. A lançadeira citrato-piruvato para a síntese de ácidos graxos e a lançadeira fosfato de glicerol (pelo menos para gordura marrom e músculo de vôo de inseto) também devem encontrar lares onde possam se dar bem com os vizinhos imediatos.
p A organização endêmica de proteínas nessas megaestruturas sugere que as mitocôndrias podem se parecer mais com um cristal duro do que com um protoplasma fluido. Ainda de alguma forma, eles parecem extremamente flexíveis quando se trata de fusão e fissão. O que acontece com sua estrutura de membrana sob esses tipos de mudanças? Os complexos são temporariamente desmontados e solubilizados como o cílio primário e o centríolo das células regulares durante a mitose? Uma pista nova e fascinante surge do trabalho que mostra que as mitocôndrias se conectam umas às outras por meio de "nanotúneis" de sua própria construção. Esses nanotúneis são completamente diferentes (até onde sabemos) da marca infundida de citoesqueleto de 'nanotubos de tunelamento' que as próprias células usam para transferir mitocôndrias inteiras umas às outras.
p Uma revisão recente de Martin Picard e seus colegas em
Tendências em biologia celular sugere uma maneira que esses nanotúneis podem se formar quando as mitocôndrias são fixadas ao citoesqueleto. Se proteínas motoras como a cinesina se apoderarem de um fragmento de uma mitocôndria fixa, ele poderia puxar um nanotúnel fino como os motores da cinesina contra outro microtúbulo. O corpo rígido da mitocôndria e sua estrutura de membrana provavelmente permaneceriam intactas. Essa projeção pode então encontrar outra mitocôndria à qual se liga.
p Picard mostrou anteriormente que cerca de metade das mitocôndrias dentro do músculo cardíaco têm junções intermitocondriais (IMJs) e cristas que se alinham em padrões regulares que se estendem através das redes mitocondriais. É improvável que este alinhamento de rede estranho surja de eventos de fissão recentes porque as mitocôndrias do coração estão fixas no lugar e mostram dinâmica de fissão / fusão mínima. Recentemente, foi demonstrado que os IMJs controlam a contratilidade ao desacoplar mitocôndrias rapidamente quando suas próprias membranas são despolarizadas. Uma coisa que seria de interesse imediato, aqui, é reexaminar a estequiometria da subunidade respiratória em mitocôndrias de coração humano para complementar os resultados relatados aqui para células renais embrionárias humanas. p © 2017 Phys.org
