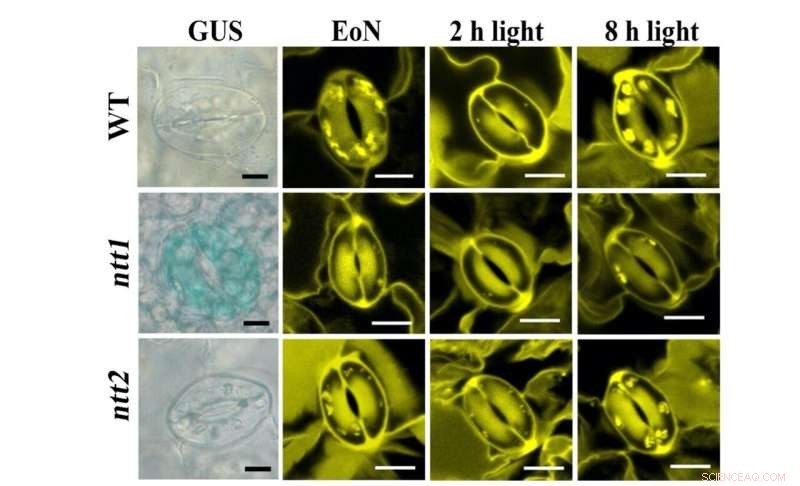
Figura 1:Coloração de transportadores NTT (azul, painel esquerdo) e grânulos de amido (amarelo, painel direito) em GCs. Crédito:Universidade de Hong Kong
Se as células-guarda (GCs) realizam fotossíntese tem sido debatido por décadas. Estudos anteriores sugeriram que os cloroplastos das células-guarda (GCCs) não podem fixar CO
2 mas estudos posteriores argumentaram o contrário. Até recentemente, permanecia controverso se GCCs e/ou GC fotossíntese desempenham um papel direto nos movimentos estomáticos. Dr. Boon Leong LIM, Professor Associado da Escola de Ciências Biológicas da Universidade de Hong Kong (HKU), em colaboração com a Dra. Diana SANTELIA da ETH Zürich, descobriu a fonte genuína de combustível dos GCs e desvendou o mistério. As descobertas foram publicadas recentemente na prestigiosa revista
Nature Communications .
De manhã, a luz do sol faz com que os estômatos, que são pequenos poros nas folhas das plantas, se abram. Isso permite que o CO
2 em e O
2 para aumentar a fotossíntese. A abertura dos estômatos consome grande quantidade de trifosfato de adenosina (ATP), a moeda de energia celular, mas as fontes de ATP para a abertura dos estômatos permaneceram obscuras. Alguns estudos sugeriram que os GCCs realizam fotossíntese e exportam ATP para o citosol para energizar a abertura dos estômatos. Nos cloroplastos do mesofilo, ATP e NADPH (fosfato de nicotinamida-adenina dinucleotídeo) são gerados a partir de fotossistemas, que são usados como combustível para a fixação de CO
2 .
Ao empregar sensores de proteína de fluorescência in planta, a equipe do Dr. Boon Leong Lim em HKU foi capaz de visualizar a produção em tempo real de ATP e NADPH nos cloroplastos das células do mesofilo (MCCs) de uma planta modelo, Arabidopsis thaliana. "Entretanto, não conseguimos detectar nenhuma produção de ATP ou NADPH em GCCs durante a iluminação. Intrigados com essa observação inesperada, contatamos uma especialista em metabolismo de células-guarda, Dra. Diana Santelia da ETH Zürich, para uma colaboração", disse Lim. Na última década, o laboratório Santelia forneceu informações profundas e importantes sobre o metabolismo do amido e do açúcar nas células-guarda (GCs) que cercam os poros estomáticos na superfície da folha.
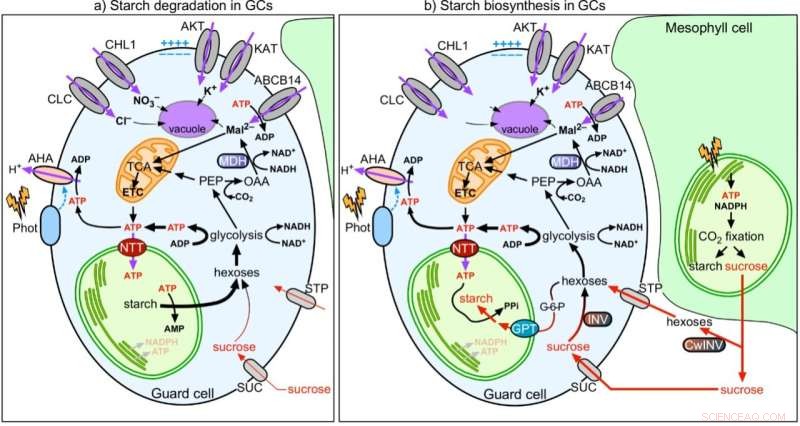
Figura 2:Modelo de coordenação da função estomática com o metabolismo do amido e do malato em células-guarda. Crédito:Universidade de Hong Kong
Em esforços conjuntos, a equipe mostra que, ao contrário das células mesofílicas (MCs), a fotossíntese do GC é pouco ativa. Os açúcares sintetizados e fornecidos pelos MCs são importados para os GCs e consumidos pelas mitocôndrias para gerar ATP para a abertura estomática. Ao contrário dos MCCs, os GCCs captam ATP citosólico através dos transportadores de nucleotídeos (NTTs) na membrana do cloroplasto para energizar a síntese de amido durante o dia. Ao amanhecer, enquanto os MCs começam a sintetizar amido e exportar sacarose, os GCs degradam o amido em açúcares para fornecer energia e aumentar a pressão de turgescência para a abertura estomática. Assim, a função dos GCCs de servir como armazenamento de amido é importante para a abertura estomática. Enquanto os MCs consertam CO
2 nos cloroplastos através do ciclo de Calvin–Benson–Bassham (CBB), CO
2 a fixação no citosol é a principal via de CO
2 A assimilação em GCs, onde o produto malato a jusante, também é um importante soluto para aumentar a pressão de turgescência para abertura estomática. Em conclusão, os GCs se comportam mais como um tecido sumidouro (recebe açúcares) do que uma fonte (fornecendo açúcares). Sua função está fortemente correlacionada com a dos MCs para coordenar eficientemente o CO
2 captação via estômatos e CO
2 fixação em MCs.
"Fiquei muito animado quando o Dr. Lim me contatou pedindo para colaborar neste projeto", disse a Dra. Diana Santelia. "Temos tentado esclarecer essas questões fundamentais usando abordagens de genética molecular. Combinar nossos respectivos conhecimentos tem sido uma estratégia vencedora", continuou ela. Dr. Sheyli LIM, o primeiro autor do artigo e ex-Ph.D. Um aluno do grupo de Lim comentou:"Os sensores de proteína de fluorescência in planta que desenvolvemos são ferramentas poderosas na visualização de mudanças dinâmicas nas concentrações de moléculas de energia em células e organelas vegetais individuais, o que nos permite resolver algumas questões-chave em bioenergética vegetal. publicar nossas descobertas em
Nature Communications usando esta nova tecnologia."

