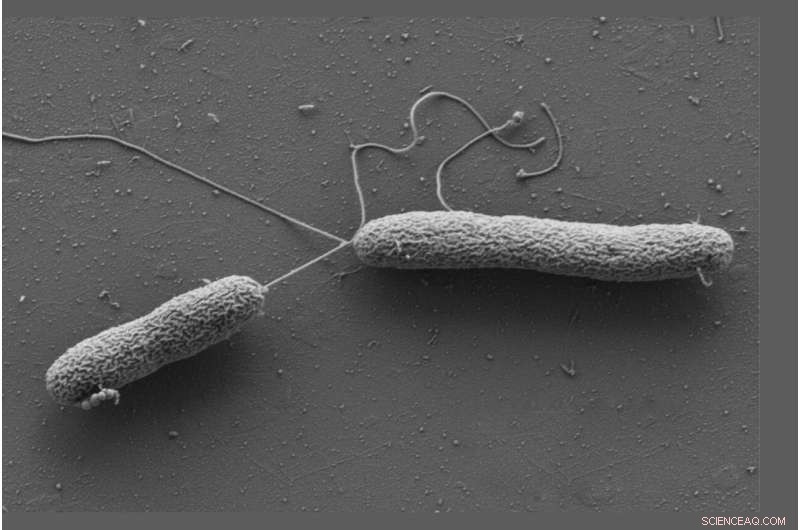
Células de Vibrio campbellii movendo-se com a ajuda de flagelos longos. Crédito:Wanner/Jung, LMU
Em humanos e animais, catecolaminas como epinefrina, norepinefrina e dopamina são hormônios de estresse comuns. O estresse pode aumentar a suscetibilidade do corpo a infecções bacterianas. No laboratório, os hormônios do estresse estimulam o crescimento de vários patógenos. Isso já havia sido observado em Salmonella (Salmonella enterica sorovar Typhimurium) e outras bactérias intestinais, Escherichia coli e o agente causador da cólera, Vibrio cholerae. Além disso, a epinefrina e a norepinefrina tornam mais fácil para as bactérias infectarem as células do corpo. E esses hormônios também influenciam a biossíntese de fatores de virulência, que permitem que os patógenos adiram, penetrem e destruam as células.
"Portanto, suspeitamos que algumas bactérias usam esses hormônios como sinais para reconhecer o ambiente do hospedeiro eucariótico", diz a microbiologista da LMU Professora Kirsten Jung. "Mas a base molecular não era conhecida." Juntamente com o professor Stephan A. Sieber da Universidade Técnica de Munique (TUM) e outros pesquisadores, Jung já identificou o sítio de ligação da epinefrina e do derivado de epinefrina fenilefrina na bactéria Vibrio campbellii. Como a equipe relata no
PNAS , o alvo de ambas as moléculas é a proteína CheW. “O significado biológico do mecanismo é que as bactérias reconhecem, por exemplo, que não estão mais na água do mar, mas no intestino de um hospedeiro”, explica Jung.
Estudos com o organismo modelo V. campbellii "Queríamos saber como as bactérias reconhecem as catecolaminas como moléculas sinalizadoras", diz o cientista da LMU. "Quais receptores controlam esse processo?" Seus experimentos consistiam em várias etapas individuais.
Para o estudo, Sieber desenvolveu um método para modificar quimicamente a epinefrina e a fenilefrina, para que os pesquisadores pudessem isolar diretamente os complexos das catecolaminas e das proteínas bacterianas ligadas. Um pré-requisito dos experimentos era que os novos compostos não tivessem quaisquer características biológicas que as moléculas não modificadas não tivessem. O grupo de Jung fez experimentos de laboratório para demonstrar que era assim. A epinefrina se liga ao ferro, enquanto o derivado da epinefrina, a fenilefrina, não. Com a escolha dos compostos, os pesquisadores queriam descartar os efeitos que surgem quando as bactérias têm um melhor suprimento de ferro.
Jung e Sieber trabalharam com Vibrio campbellii como organismo modelo. A bactéria marinha infecta peixes, camarões, lulas e muitos outros invertebrados marinhos. Eles adicionaram Vibrio campbellii às catecolaminas quimicamente modificadas e lisaram as células. Em seguida, eles extraíram do lisado todas as proteínas às quais uma molécula se ligou e as caracterizaram usando análise de proteoma. Isto resultou num enriquecimento particular da proteína de quimiotaxia solúvel CheW.
Posteriormente, o grupo de Jung isolou a proteína CheW diretamente das bactérias, purificou-a e mediu sua afinidade de ligação às catecolaminas. No processo, os pesquisadores descobriram algo surpreendente:os hormônios não se ligam aos próprios quimiorreceptores, como originalmente esperado, mas à proteína de acoplamento CheW, que está localizada entre os receptores e uma cascata de transdução de sinal. Todo esse sistema de percepção de estímulos controla o movimento da bactéria em um gradiente químico.
"Nosso estudo fornece novos insights sobre a comunicação das bactérias com seu hospedeiro", resume Jung. "Conseguimos mostrar que o comportamento de natação das bactérias é modificado pelos hormônios do hospedeiro, que são controlados pelo CheW". A motilidade, e em particular a motilidade direcionada, é decisivamente importante para a colonização do hospedeiro, pois as bactérias procuram deliberadamente colonizar um organismo e conquistar todos os nichos. Na próxima etapa, Jung agora quer descobrir se o mesmo mecanismo pode ser detectado em outras bactérias.
