Resumo gráfico. Crédito:Host de célula e micróbio (2022). DOI:10.1016/j.chom.2022.03.014
A fagoterapia, que usa vírus conhecidos como bacteriófagos para tratar infecções bacterianas, é um procedimento médico de longa data cujos mecanismos de ação ainda são pouco compreendidos. Cientistas do Institut Pasteur e do CNRS demonstraram in vivo em um modelo murino que as bactérias são capazes de regular sua expressão gênica para evitar os numerosos bacteriófagos presentes no ambiente intestinal. Esta pesquisa explica a diferença na eficácia do bacteriófago entre as condições in vitro e in vivo. Os resultados foram publicados na revista
Cell Host &Microbe em 13 de abril de 2022.
A terapia fágica é uma abordagem médica que envolve o tratamento de doenças infecciosas bacterianas usando a capacidade natural de certos vírus, conhecidos como bacteriófagos, de matar bactérias que eles reconhecem especificamente. Um declínio significativo no uso desta estratégia terapêutica descoberta há mais de 100 anos foi observado no Ocidente após o desenvolvimento de antibióticos. No entanto, diante de um aumento alarmante do número de infecções causadas por bactérias resistentes a antibióticos e da perspectiva preocupante de ficar sem opções de tratamento, os cientistas procuram esclarecer o mecanismo de ação dos bacteriófagos.
Bactérias e bacteriófagos são as entidades mais abundantes na microbiota intestinal humana. Embora os bacteriófagos matem as bactérias, as duas populações antagonistas coexistem em equilíbrio no intestino.
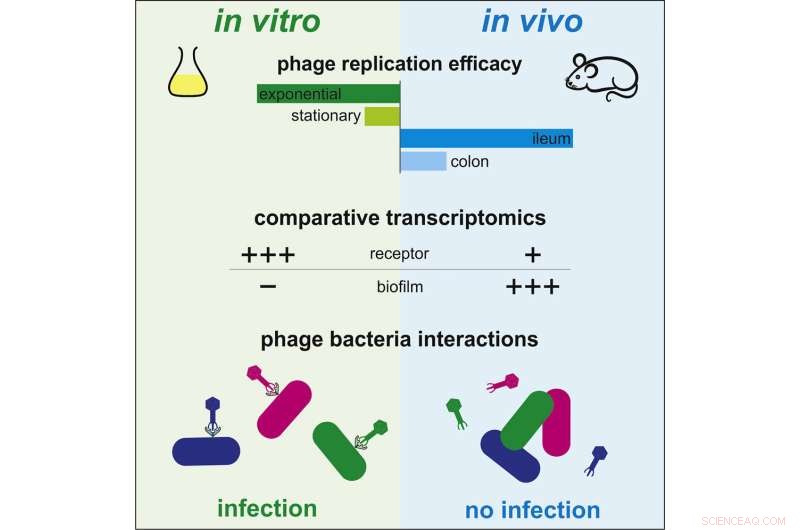
Até agora, dados científicos insuficientes estavam disponíveis para entender como a terapia fágica funciona in vivo. As interações entre bactérias e bacteriófagos, em contraste, têm sido extensivamente estudadas in vitro. Nessas condições, os bacteriófagos infectam rapidamente as bactérias, replicam e destroem as bactérias, enquanto liberam novos vírus capazes de infectar outras bactérias. No entanto, a dinâmica observada entre esses dois microrganismos é muito diferente no intestino dos mamíferos. Alguns bacteriófagos que são eficazes em meio de cultura são totalmente ineficazes no ambiente intestinal.
Para entender essa diferença, cientistas do Institut Pasteur e do CNRS decidiram comparar o perfil de expressão gênica, ou transcriptoma, da bactéria Escherichia coli em ambos os contextos:meio de cultura e intestino. Usando esse método, eles revelaram regulações genéticas que caracterizam a adaptação da bactéria ao ambiente intestinal.
Ao examinar de perto os genes envolvidos nessa adaptação, eles revelaram quatro genes que modulam a suscetibilidade da bactéria aos bacteriófagos. "Observamos que certos genes necessários para a infecção por bacteriófagos são expressos menos no intestino do que in vitro, protegendo assim as bactérias dos bacteriófagos", comentou Laurent Debarbieux, chefe da unidade de bacteriófagos, bactérias e hospedeiras do Institut Pasteur (unidade conjunta do CNRS). e último autor do estudo. Os cientistas conseguiram verificar sua teoria eliminando a expressão de um gene em particular. Eles observaram que a suscetibilidade bacteriana a um bacteriófago foi significativamente reduzida. Consequentemente, as bactérias no intestino são capazes de resistir à predação por bacteriófagos modulando a expressão de certos genes em vez de mutar seu genoma.
Este estudo demonstra, portanto, que o ambiente desempenha um papel predominante nas interações entre bactérias e bacteriófagos. Essas descobertas abrem caminho para uma melhor utilização de bacteriófagos para fins terapêuticos.
