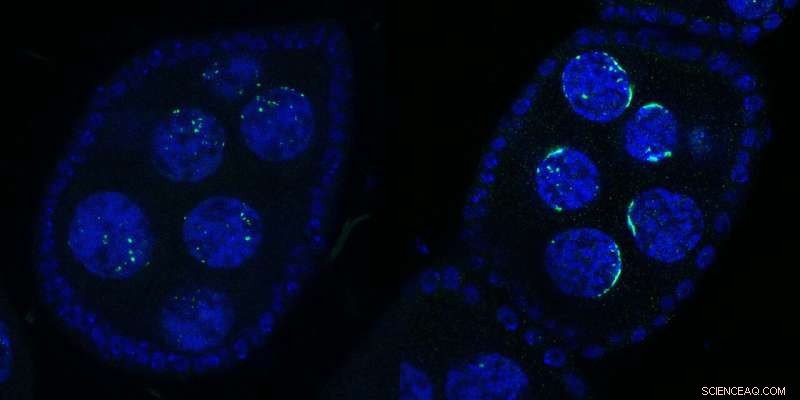
Duas câmaras de ovos de Drosophila contendo vários núcleos:Tipo Selvagem (esquerda) ou após inativação de Kipferl (direita). O DNA é mostrado em azul e Rhino em verde. Após a mutação ou deleção da proteína parceira Kipferl (à direita), o Rhino perde sua afinidade pelas sequências do cluster de piRNA em todo o genoma (pontos verdes no painel esquerdo), mas é sequestrado pelos arranjos de satélite pericentroméricos (formas verdes em forma de crescente à direita painel). As formas crescentes inspiraram o nome “Kipferl”, o nome de uma pastelaria austríaca. Crédito:Baumgartner/Brennecke/IMBA
Uma grande parte do nosso DNA é composta de elementos repetitivos de DNA egoístas, alguns dos quais podem pular de um local no genoma para outro, potencialmente danificando o genoma. Pesquisadores do Instituto de Biotecnologia Molecular da Academia Austríaca de Ciências (IMBA) descrevem como diferentes tipos de elementos repetitivos de DNA são controlados pelo mesmo mecanismo de silenciamento em ovários de moscas-das-frutas.
Central para suas descobertas é uma proteína não caracterizada que os pesquisadores chamaram de "Kipferl", que garante o controle efetivo dos genes saltadores. As descobertas sugerem que diferentes elementos egoístas competem pelo sistema de defesa do genoma do hospedeiro e que Kipferl pode ser a primeira de uma série de moléculas de ação semelhante ainda a serem descobertas. As descobertas são publicadas em
eLife .
Cerca de metade do genoma humano e um quinto do genoma da mosca da fruta é composto de parasitas genéticos que se assemelham a genes que podem fazer cópias de si mesmos e se inserir em áreas aleatórias do nosso genoma, potencialmente interrompendo a expressão gênica normal. Múltiplos mecanismos de defesa evoluíram para manter esses chamados transposons sob controle.
Um desses mecanismos é um sistema de interferência de RNA chamado via piRNA. A via piRNA é uma pequena via de silenciamento de RNA conservada em todo o reino animal, de esponjas a mamíferos. Esse mecanismo de silenciamento usa piRNAs gerados a partir de sequências ricas em transposons no DNA chamadas "agrupamentos de piRNA".
Os piRNAs são pequenos RNAs que se acoplam com as chamadas proteínas Argonautas da maquinaria de silenciamento para direcionar os transposons complementares à sua sequência. Assim, esses piRNAs servem como esquemas para identificar e silenciar transposons com sequências complementares no genoma, não importa o quão longe eles foram capazes de saltar.
A mosca da fruta Drosophila melanogaster, na qual a via do piRNA foi identificada pela primeira vez, usa uma proteína chamada "Rhino" para encontrar aglomerados de piRNA no genoma. No entanto, como o Rhino reconhece os aglomerados de piRNA no DNA permaneceu desconhecido.
"Dados in vitro anteriores mostraram uma afinidade do Rhino por uma marca epigenética específica, a modificação da cromatina H3K9me3", diz o líder do grupo IMBA, Julius Brennecke, autor correspondente do estudo. Esta modificação é um marcador de "heterocromatina", uma forma de DNA compactado em que os genes são silenciados.
No entanto, H3K9me3 não é específico para clusters de piRNA, mas também é frequentemente encontrado em outras regiões densamente compactadas do genoma. Lá, H3K9me3 é ligado pela principal proteína heterocromatina 1 (HP1), um parente próximo do Rhino.
Por que HP1 e Rhino se ligam a diferentes subconjuntos de heterocromatina, mesmo que ambos tenham uma afinidade comparável para a mesma modificação de cromatina, não ficou claro há muito tempo. "Sem dúvida, H3K9me3 foi necessário, mas não suficiente para explicar a ligação do Rhino à cromatina. Portanto, sabíamos que deve haver pistas moleculares adicionais que ajudam a direcionar Rhino para clusters de piRNA", acrescenta Brennecke.
Na busca por essa sugestão molecular, a equipe catalogou os interagentes diretos do Rhino, procurando uma proteína parceira que possa guiar o Rhino aos clusters de piRNA. Usando uma combinação de abordagens genéticas, genômicas e de imagem, os pesquisadores identificaram o "companheiro" de Rhino nos ovários de Drosophila:uma proteína contendo várias dobras de dedos de zinco que eles chamaram de "Kipferl".
Kipferl não se liga apenas ao Rhino, mas também usa seus dedos de zinco para a ligação específica de sequência a motivos de DNA ricos em guanosina. A equipe descobriu que a maioria dos clusters de piRNA são definidos através da combinação de sítios de ligação de DNA específicos de Kipferl com heterocromatina local. Nesses locais, a interação do Rhino com as marcas epigenéticas H3K9me3 é estabilizada pelo Kipferl, o que explica por que o Rhino se liga apenas a uma pequena parte de toda a heterocromatina encontrada no genoma.
Para adicionar um nível de complexidade, a equipe sabia que o Rhino não apenas localiza clusters de piRNA. Recentemente Rhino foi mostrado para se ligar aos chamados "matrizes de satélite". São sequências repetitivas de DNA não codificador e não transpositor localizado próximo aos centrômeros dos cromossomos.
“Vimos um efeito impressionante no Rhino quando geramos moscas com Kipferl mutante ou ausente e as observamos ao microscópio”, diz a primeira autora Lisa Baumgartner, candidata a doutorado no laboratório Brennecke no IMBA. Quando Kipferl foi mutado, o Rhino não localizou mais os clusters de piRNA em todo o genoma. Em vez disso, ele se acumulou fortemente em matrizes de satélites genômicos.
"Em vez de pontos menores distribuídos ao redor do núcleo, vimos Rhino formando formas distintas em forma de crescente. mais tarde que essas estruturas correspondiam a trechos de Megabase de matrizes de satélites." Assim, os cientistas mostraram que Kipferl ajudou a distribuir adequadamente o Rhino para clusters de piRNA e evitar seu sequestro em matrizes de satélites.
O rinoceronte é uma das proteínas de evolução mais rápida no genoma da mosca. Brennecke e sua equipe levantam a hipótese de que essa rápida evolução pode muito bem ser devido à pressão evolutiva positiva proveniente das matrizes de satélites.
"As matrizes Satellite não se transpõem, mas podem se recombinar. No entanto, se o fizerem de maneira descontrolada, braços cromossômicos inteiros podem ser perdidos. Portanto, as matrizes Satellite podem precisar de um mecanismo de controle envolvendo Rhino e outros componentes da via piRNA para ajudar a embalá-los em heterocromatina apertada. Esta pode ser a razão pela qual as matrizes de satélite parecem querer sequestrar todos os rinocerontes que pudessem encontrar", explica Baumgartner.
Baumgartner pensa que Rhino e a via piRNA podem ter papéis muito diferentes em suas interações com as matrizes de satélites ou os clusters e transposons de piRNA. "O salto e a multiplicação de transposons representam um perigo para a funcionalidade do genoma, tornando necessário que a via do piRNA os silencie", diz ela.
"Portanto, aos olhos dos transposons, a via do piRNA é o 'inimigo' que os impede de se espalhar pelo genoma. As matrizes de satélite, por outro lado, simplesmente precisam de uma camada adicional de controle para garantir que possam manter sua alta cópia número sem danificar o genoma por recombinação indesejada. Portanto, aos olhos das matrizes Satellite, imagino que o Rhino seja um fator que garanta sua sobrevivência", elabora.
Com base nessas observações e análises, os cientistas sugerem que as matrizes Satellite podem estar usando outra proteína parceira como Kipferl para ajudar a localizar o Rhino em seu DNA.
"Para combater o sequestro de Rhino pelas matrizes de satélite, especulamos que Kipferl pode ter evoluído a partir de uma necessidade de ajudar a redirecionar Rhino para os clusters de piRNA. Portanto, nossas descobertas sugerem que Rhino pode ser pego em um fogo cruzado de conflitos genéticos," diz Brennecke. Além disso, Rhino é expresso em testículos e ovários na mosca da fruta, enquanto Kipferl é expresso apenas em ovários. "Kipferl pode ser o primeiro de vários fatores de orientação do Rhino ainda a serem descobertos", conclui Brennecke.
+ Explorar mais Como as células hackeiam seus próprios genes
