Os cientistas identificam a ligação entre o desenvolvimento da luz e do cloroplasto
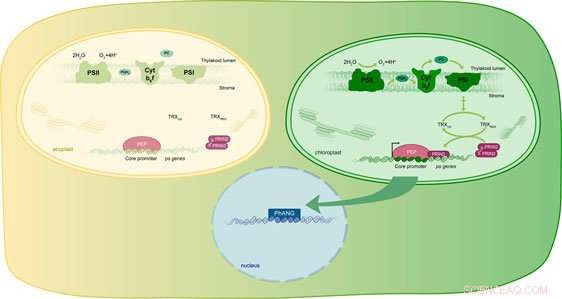 p Visão geral esquemática sobre o mecanismo molecular que liga a luz e o desenvolvimento do cloroplasto (criado por Daria Chrobok):Quando a luz é recebida pela primeira vez pela célula, etioplastos (lado superior esquerdo) se desenvolvem em cloroplastos (lado superior direito). O fotossistema II (PSII) começa a usar a energia da luz para dividir a água. Os elétrons liberados são transferidos ao longo da cadeia de transporte de elétrons que consiste em plastoquinona (PG), citocromo b (Cyt b6f) e plastocianina (PC) para o fotossistema I (PSI). Do PSI, os elétrons são transferidos em várias etapas para a tiorredoxina, que se oxida e, em seguida, transfere os elétrons posteriormente para o PRIN2. PRIN2 agora pode ativar PEP e PEP ativa a expressão dos genes relacionados à fotossíntese. Crédito:Universidade de Umea
p Visão geral esquemática sobre o mecanismo molecular que liga a luz e o desenvolvimento do cloroplasto (criado por Daria Chrobok):Quando a luz é recebida pela primeira vez pela célula, etioplastos (lado superior esquerdo) se desenvolvem em cloroplastos (lado superior direito). O fotossistema II (PSII) começa a usar a energia da luz para dividir a água. Os elétrons liberados são transferidos ao longo da cadeia de transporte de elétrons que consiste em plastoquinona (PG), citocromo b (Cyt b6f) e plastocianina (PC) para o fotossistema I (PSI). Do PSI, os elétrons são transferidos em várias etapas para a tiorredoxina, que se oxida e, em seguida, transfere os elétrons posteriormente para o PRIN2. PRIN2 agora pode ativar PEP e PEP ativa a expressão dos genes relacionados à fotossíntese. Crédito:Universidade de Umea
p Há muito se supõe que a luz ativa a expressão do gene cloroplástico por meio da chamada regulação redox mediada por tiol. Contudo, o mecanismo que deu origem a este regulamento permaneceu indefinido até agora. Åsa Strand e seu grupo no Umeå Plant Science Center já identificaram os componentes envolvidos neste mecanismo regulador redox. Seus resultados são publicados na revista
Nature Communications . p O cloroplasto é o local da célula onde ocorre a fotossíntese. Quando uma muda sai do solo, gradualmente fica verde, e durante esse processo de esverdeamento, a maquinaria fotossintética nos cloroplastos se desenvolve e se torna totalmente funcional. O estabelecimento da fotossíntese é um processo complicado que envolve a ativação da expressão gênica no cloroplasto em resposta à luz. Åsa Strand e seu grupo identificaram um componente que conecta o sinal de luz à ativação da expressão gênica no cloroplasto.
p Foi demonstrado que certas proteínas, chamadas tioredoxinas, transferir elétrons, derivado principalmente da luz, à proteína PRIN2 (PLASTID REDOX INSENSITIVE2). PRIN2 torna-se reduzido e muda sua estrutura de um dímero (ou seja, duas proteínas PRIN2 estão ligadas) para um monômero (proteínas individuais). Os monômeros PRIN2 então ativam a expressão do gene fotossintético no cloroplasto. Esse tipo de regulação é chamada de regulação redox mediada por tiol porque o grupo químico funcional que media a transferência de elétrons é o grupo tiol contendo enxofre.
p "Identificamos o PRIN2 há vários anos. Sabíamos que ele era sensível às alterações redox e que era necessário para a expressão normal do gene no cloroplasto", explica Åsa Strand. "Nós agora mostramos que o PRIN2 é regulado pela luz via tiorredoxinas e que então ativa um complexo de proteínas chamado PEP. Esse complexo de proteínas é responsável pela expressão dos genes relacionados à fotossíntese no cloroplasto."
p O complexo proteico PEP (RNA polimerase codificado por plastídio) lê as informações armazenadas no DNA do genoma do cloroplasto e as copia em RNA (ácido ribonucléico). O RNA serve então como modelo para traduzir as informações armazenadas no DNA em proteínas. PEP é um grande complexo de proteínas que precisa de várias proteínas associadas para ganhar sua função completa. Uma dessas proteínas associadas é PRIN2.
p As proteínas necessárias para uma maquinaria fotossintética totalmente funcional são parcialmente codificadas no núcleo e parcialmente no genoma do cloroplasto de uma célula. Assim, alguma forma de comunicação entre os dois compartimentos celulares é necessária para garantir que todos os componentes estejam disponíveis no momento certo durante o desenvolvimento da muda. PRIN2 desempenha um papel essencial na comunicação entre os dois compartimentos porque o estado do complexo PEP liga o estado funcional do cloroplasto ao núcleo, permitindo que a planta sincronize a expressão de genes fotossintéticos dos genomas nuclear e do cloroplasto durante o desenvolvimento da muda.
