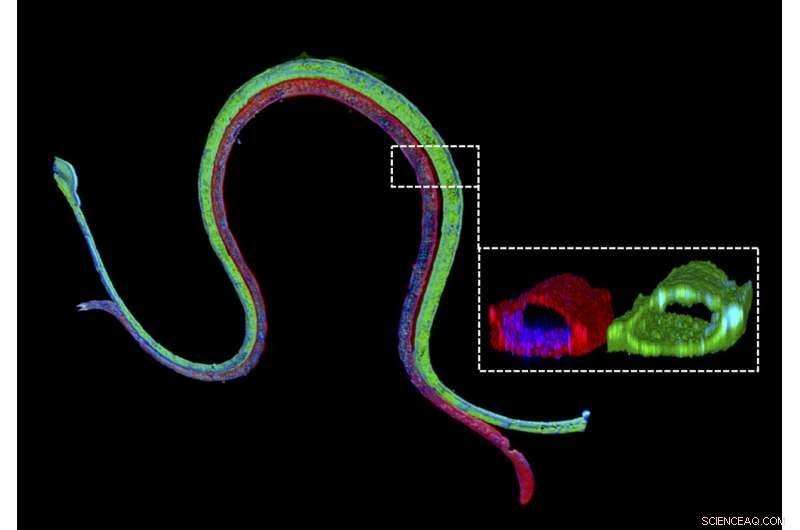
Coloração por imunofluorescência de um túbulo proximal vascularizado bioprinted 3D com um marcador epitelial do túbulo proximal corado em verde no canal do túbulo proximal e um marcador endotelial vascular corado em vermelho no canal vascular adjacente. A seção transversal ampliada ilustra que os dois tipos diferentes de células formam estruturas luminais perfusáveis em seus respectivos canais. Crédito:Wyss Institute da Harvard University
Todos os dias, nossos rins enfrentam a difícil tarefa de limpar continuamente nosso sangue para evitar desperdícios, sal e excesso de fluido se acumulam dentro de nossos corpos. Para alcançar isto, os aproximadamente um milhão de unidades de filtração (glomérulos) dos rins removem primeiro os resíduos e os nutrientes preciosos da corrente sanguínea, então, estruturas especializadas conhecidas como túbulos proximais reabsorvem as moléculas "boas", devolvendo-as à corrente sanguínea. Embora as funções reabsortivas do túbulo proximal possam ser comprometidas por drogas, produtos químicos, ou doenças genéticas e transmitidas pelo sangue, nossa compreensão de como esses efeitos ocorrem ainda é limitada.
Para permitir o estudo da reabsorção renal fora do corpo humano, Jennifer Lewis, membro do corpo docente do Wyss Institute, Sc.D., e sua equipe trabalhando na 3-D Organ Engineering Initiative do Wyss Institute, que ela co-lidera, e em colaboração com o Roche Innovation Center Basel na Suíça, criou um modelo de túbulo proximal vascularizado 3-D no qual túbulos e vasos sanguíneos independentemente perfusáveis são impressos adjacentes uns aos outros dentro de uma matriz extracelular projetada. Este trabalho baseia-se em um modelo de túbulo proximal 3-D continuamente perfundido relatado anteriormente pela equipe que ainda não tinha um compartimento de vaso sanguíneo funcional. Usando seu dispositivo de última geração, a equipe mediu o transporte de glicose do túbulo proximal aos vasos sanguíneos, junto com os efeitos da hiperglicemia, uma condição associada ao diabetes em pacientes. Seu estudo foi publicado no Anais da Academia Nacional de Ciências ( PNAS )
Lewis também é Professor Hansjörg Wyss de Engenharia Inspirada na Biologia da Escola de Engenharia e Ciências Aplicadas (SEAS) de Harvard John A. Paulson, o Jianmin Yu Professor de Artes e Ciências e membro do Harvard Stem Cell Institute.
"Construímos esses dispositivos renais vivos em poucos dias e eles podem permanecer estáveis e funcionais por meses, "disse o primeiro autor Neil Lin, Ph.D., que é Roche Fellow e Postdoctoral Fellow na equipe de Lewis. "Importante, esses túbulos proximais vascularizados 3-D exibem as morfologias de células epiteliais e endoteliais desejadas e arquiteturas luminais, bem como a expressão e localização correta de proteínas estruturais e de transporte chave, e fatores que permitem que os compartimentos tubular e vascular se comuniquem entre si. "
Como primeiro passo para testar drogas e modelar doenças, a equipe induziu "hiperglicemia", uma condição de alto teor de glicose típica de diabetes e um fator de risco conhecido para doenças vasculares, em seu modelo, circulando uma concentração de glicose quatro vezes maior do que o normal através do compartimento do túbulo proximal. "Descobrimos que altos níveis de glicose transportada para as células endoteliais no compartimento vascular causaram danos às células, "disse Kimberly Homan, Ph.D., co-autor do estudo e Pesquisador Associado do grupo de Lewis no Wyss Institute e SEAS. "Ao circular uma droga através do túbulo que inibe especificamente um grande transportador de glicose nas células epiteliais do túbulo proximal, evitamos que essas alterações prejudiciais acontecessem nas células endoteliais dos vasos adjacentes. "
O foco imediato da equipe é ampliar ainda mais esses modelos para uso em aplicações farmacêuticas. "Nosso sistema pode permitir a triagem de bibliotecas de drogas focadas para toxicidade renal e, assim, ajudar a reduzir os experimentos com animais, "disse Annie Moisan, Ph.D., um co-autor e colaborador da indústria no estudo, e principal cientista do Roche Innovation Center Basel. "Estou entusiasmado com os esforços contínuos de nós e de outros para aumentar a relevância fisiológica de tais modelos, por exemplo, incorporando células específicas do paciente e células doentes, uma vez que a eficácia e segurança personalizadas são os objetivos finais de prever as respostas clínicas aos medicamentos. "
"Nosso novo modelo de rim 3-D é um avanço empolgante, pois recapitula mais completamente os segmentos do túbulo proximal encontrados no tecido renal nativo, "disse Lewis." Além de suas aplicações imediatas para rastreamento de drogas e modelagem de doenças, também estamos explorando se esses dispositivos vivos podem ser usados para aumentar a diálise renal. "Atualmente, máquinas de diálise que salvam vidas filtram o sangue, mas eles são incapazes de recuperar nutrientes preciosos e outras espécies do filtrado que o corpo necessita para muitas de suas funções, o que pode causar deficiências e complicações específicas no futuro. Lewis and her colleagues believe that 3-D bioprinted vascularized tubules may lead to improved renal replacement therapies.
"This study presents a significant step forward in human kidney engineering that enables human disease and drug-related studies to be carried out over extended periods of time in vitro. It also represents a major step forward for the Wyss Institute's 3-D Organ Engineering Initiative, which aims to generate functional organ replacements with enhanced functionalities for patients in need, " said Wyss Institute Founding Director Donald Ingber, M.D., Ph.D., who is also the Judah Folkman Professor of Vascular Biology at HMS and the Vascular Biology Program at Boston Children's Hospital, as well as Professor of Bioengineering at SEAS.