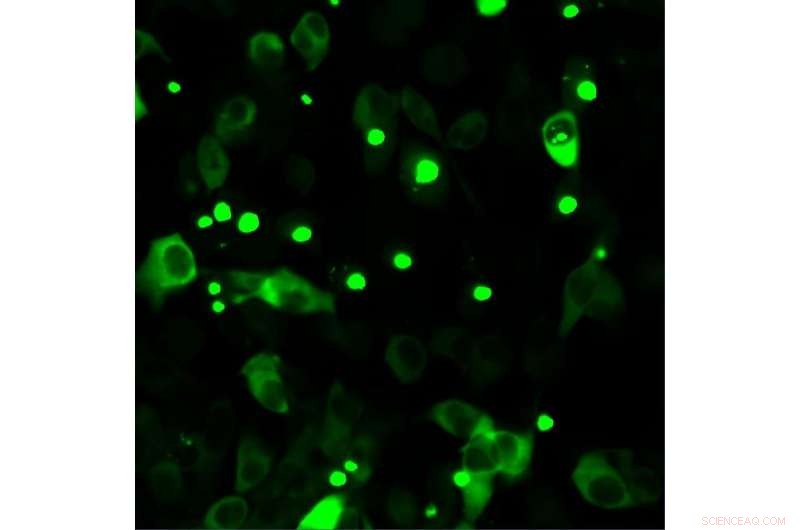
Células humanas produzindo huntingtina mutante marcada com fluorescência. A Huntingtina mutada tende a se acumular, o que é patológico e visível na forma de pontos. Crédito:Universidade de Bremen
A coreia de Huntington é uma doença hereditária que leva a deficiências cognitivas e motoras e morte. Cientistas da Universidade de Bremen trabalharam com parceiros internacionais para elucidar o mecanismo pelo qual a proteína huntingtina mutante pode ser mantida sob controle.
"Descobrimos um mecanismo pelo qual os próprios auxiliares de dobramento de proteínas do corpo mantêm a proteína huntingtina mutante afastada", explica a líder do projeto e professora Janine Kirstein da Universidade de Bremen. Os auxiliares de dobramento de proteínas permitem que as proteínas assumam e mantenham sua estrutura correta para desempenhar suas funções multifacetadas. Os pesquisadores já estavam familiarizados com três dos auxiliares, mas o que eles ainda não sabiam era como era a ligação com a proteína huntingtina mutada, qual dos três auxiliares de dobra poderia reconhecer a proteína mutante e como era sua ligação.
"Agora conseguimos identificar isso usando o método de espectrometria de massa de reticulação", diz o bioquímico. Este método pode determinar com precisão as interações de proteínas. No entanto, ainda havia um longo caminho a percorrer em termos de compreensão do vínculo. "Foi apenas por meio de modelagem que conseguimos entender melhor a interação entre os auxiliares de dobramento de proteínas e a huntingtina mutante".
Pesquisa bem-sucedida por meio de interdisciplinaridade comprovada O sucesso desses novos insights está na prática da interdisciplinaridade:"O fato de termos conseguido obter nossos resultados com tanta precisão se deveu principalmente à excelente cooperação entre as Faculdades de Biologia/Química e Engenharia de Produção da Universidade de Bremen", diz Kirstein. "Em bioquímica, precisávamos de pesquisadores para nosso projeto que pudessem nos apoiar em nosso trabalho experimental de laboratório com modelos auxiliados por computador".
Sua aluna de pós-graduação Yasmin Richter encontrou a experiência necessária em ciências da engenharia com sua ex-colega no programa de mestrado em Bioquímica e Biologia Molecular, Isabell Grothaus. Ela está fazendo seu doutorado no grupo de trabalho liderado pela Dra. Susan Köppen e pelo Professor Lucio Colombi Ciacchi. Foi assim que os dois investigadores juniores desenvolveram uma cooperação entre as duas faculdades. "Os engenheiros simularam a ligação entre os auxiliares de dobramento de proteínas e a proteína huntingtina mutante em um computador para nós, e então pudemos validar experimentalmente a modelagem em nosso laboratório com proteínas purificadas e em culturas de células", explica Kirstein.
Outro obstáculo foi a estrutura anteriormente desconhecida da proteína huntingtina mutada. Os parceiros de cooperação Martin Kulke e Josh Vermaas, da Michigan State University, nos EUA, puderam ajudar aqui, postulando uma estrutura que permitiria que a modelagem fosse realizada no computador. Outro importante parceiro de cooperação foi Fan Liu com os experimentos de espectrometria de massa realizados no Leibniz Research Institute for Molecular Pharmacology em Berlim. É também onde Kirstein liderou um grupo de trabalho até 2019, antes de sua nomeação para a Universidade de Bremen.
Com base nos resultados da pesquisa "Com este trabalho, conseguimos entender o mecanismo pelo qual um auxiliar de dobramento de proteínas detecta seletivamente uma proteína mutada associada à doença e a torna inofensiva. Isso por si só não é suficiente para uso terapêutico", diz Kirstein. "Mas você pode aproveitar esses resultados e desenvolver estratégias para induzir ou estabilizar especificamente esses auxiliares de dobramento específicos do corpo, a fim de suprimir a toxicidade da huntingtina mutante".
A pesquisa foi publicada em
Nature Communications .
+ Explorar mais As proteínas da membrana humana atingem o equilíbrio evolutivo
