Crédito CC0:domínio público
Peptides, que são sequências curtas de aminoácidos, desempenham um papel vital na saúde e na indústria, com uma ampla gama de usos médicos, incluindo antibióticos, drogas antiinflamatórias e anticâncer. Eles também são usados na indústria de cosméticos e para melhorar o desempenho atlético. Alterar a estrutura dos peptídeos naturais para produzir compostos melhorados é, portanto, de grande interesse para os cientistas e a indústria. Mas como as máquinas que produzem esses peptídeos funcionam ainda não está claro.
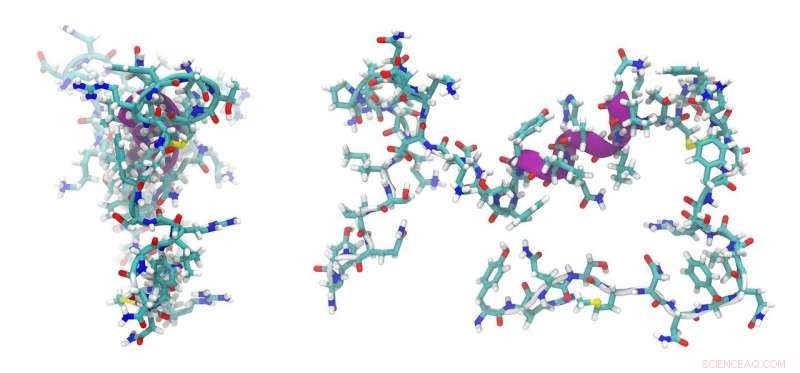
O professor associado Max Cryle do Biomedicine Discovery Institute (BDI) da Monash University revelou um aspecto-chave da maquinaria de peptídeos em um artigo publicado em Nature Communications hoje, isso fornece uma chave para o Santo Graal da reengenharia de peptídeos.
As descobertas irão promover o trabalho de seu laboratório na reengenharia de antibióticos glicopeptídicos para conter a ameaça global urgente representada pela resistência antimicrobiana, e mais amplamente para melhorar as propriedades dos péptidos em geral.
"As máquinas de síntese de peptídeos são frequentemente linhas de montagem modulares, com cada módulo composto de diferentes partes componentes. Mudando o que você faz nessas linhas de montagem, isso é, peptídeos com novas bioatividades, é um 'Santo Graal' no redesenho, "O professor associado Cryle disse." Uma das coisas que tentamos entender neste estudo foi de onde vem a seletividade dessas máquinas - eles são muito seletivos para fazer um peptídeo específico e entender de onde vem essa especificidade é um pouco mistério, " ele disse.
"Fomos capazes de caracterizar estruturalmente uma parte desse mecanismo que gera as ligações dentro dos peptídeos em um estágio que não havia sido determinado anteriormente. O que mostramos é que esses domínios responsáveis pela ligação de aminoácidos em peptídeos não desempenham um papel geral na seleção dos aminoácidos durante este processo. "
"Esta é uma boa notícia do ponto de vista da reengenharia, porque significa que não precisamos nos preocupar em mudar várias peças da máquina para fazer alterações de aminoácidos individuais, só precisamos nos concentrar em mudar o bloco de construção que entra e isso é bastante promissor. "
O professor associado Cryle liderou uma equipe multidisciplinar de cientistas que utilizou uma variedade de técnicas para modelar as estruturas dos peptídeos, incluindo o uso do Síncrotron Australiano para cristalografia de raios X juntamente com técnicas químicas e bioquímicas. Ele colaborou com grupos em Canberra, Brisbane e Alemanha que ajudaram com modelagem computacional e bioinformática.
"Nossa capacidade de entender as enzimas que fazem os peptídeos naturais é a chave para a nossa capacidade de produzir outros melhorados para tratar de questões como a resistência antimicrobiana, ", disse ele." Agora podemos realmente começar a pensar em maneiras de mudar a aceitação do maquinário de diferentes blocos de construção e, dessa forma, podemos fazer novos peptídeos com propriedades antibacterianas melhoradas, " ele disse.
No futuro, uma colaboração com o grupo do Dr. Evi Stegmann na Universidade de Tübingen, na Alemanha, ajudará a traduzir as descobertas de uma solução teórica de laboratório para o desenvolvimento de uma produção em escala comercial de novos e melhores antibióticos, ele disse.