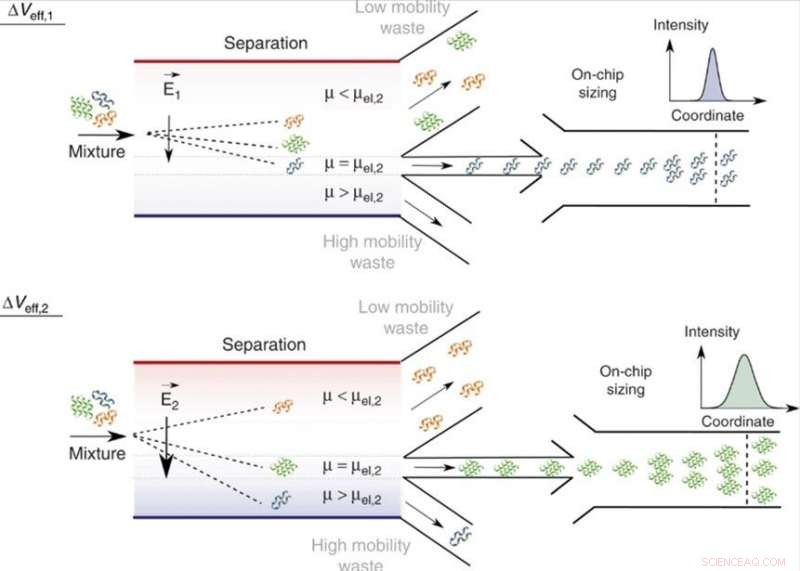
Separação on-chip e análise de misturas em fase líquida. Ajustando a tensão efetiva, ΔVeff, moléculas de uma mobilidade eletroforética específica, μ =μel, e, portanto, de uma carga específica para a razão do raio hidrodinâmico, qRh, pode ser direcionado para a área de análise com aqueles de valores de mobilidade menores (μ <μel) e maiores (μ> μel) direcionados para os canais de coleta de resíduos. Como a tensão aplicada pode ser variada, apenas uma única unidade de análise é necessária e a largura da câmara de separação pode ser mantida restrita, permitindo que o dispositivo retenha uma eficiência de alta tensão e uma velocidade de processamento rápida. Na área de análise, as frações são dimensionadas por meio de dimensionamento difusional microfluídico (MDS), monitorando seu movimento espaço-temporal em condições de fluxo laminar. Crédito:Microsystems &Nanoengineering, doi:10.1038 / s41378-019-0072-3
Sistemas microfluídicos são usados em biologia molecular, bioquímica e biotecnologia para analisar rapidamente misturas biomoleculares heterogêneas com altas taxas de recuperação e volumes de amostra por minuto. Contudo, é um desafio combinar processos preparativos e analíticos em um único dispositivo para uma análise integrada rápida. Em um estudo recente agora publicado em Microsistemas e Nanoengenharia , Kadi L. Saar e colegas de trabalho nos departamentos interdisciplinares de química, física, e Fluidic Analytics Limited em Cambridge, REINO UNIDO., desenvolveram um chip que combina as duas etapas de preparação e análise.
Inicialmente, eles usaram voltagem para separar moléculas de proteína dentro de uma mistura binária de biomoléculas de tamanhos iguais indiscerníveis por meio de técnicas convencionais de dimensionamento ou resolução. Depois disso, a equipe de pesquisa usou o novo dispositivo para obter uma impressão digital 2-D de uma mistura heterogênea de proteínas. Os resultados irão abrir novas possibilidades para adquirir dados multiparâmetros rápidos em sistemas biomoleculares em uma escala de tempo curta.
As técnicas microfluídicas são atraentes para analisar amostras biológicas devido aos requisitos de amostra muito baixos e uma alta taxa de recuperação. As plataformas podem fornecer velocidade de análise insuperável no nível de unidades individuais de operação ou fornecer várias unidades com fluxo de trabalho diretamente combinado, sem transferência de amostra entre as unidades. Essas transferências ocorrem através de conectores ou tubos e introduzem dispersão na amostra, afetando o desempenho do sistema. O fluxo de trabalho aqui proposto pode separar misturas heterogêneas para determinar os componentes de interesse e reduzir complexidades para processamento posterior da mistura para sua purificação.
Os pesquisadores já haviam introduzido uma variedade de estratégias de separação molecular baseadas em fluxo contínuo em escala de mícron, incluindo eletroforese de fluxo livre, dieletroforese, magnetoforese e separação acustoforética. Estratégias de detecção, como fluorescência induzida por laser ou LED (LIF), quimiluminescência ou abordagens eletroquímicas podem ser arraigadas em paralelo dentro de tais plataformas de separação microfluídica. As informações analíticas sobre os compostos separados podem ser obtidas com estratégias off-line, como espectroscopia de massa ou SDS-PAGE, mas as técnicas podem limitar a velocidade de processamento em um único dispositivo, causando perda de amostra ou contaminação.
Saar et al. portanto, desenvolveu a separação totalmente integrada e a caracterização quantitativa de amostras biomoleculares heterogêneas em um único dispositivo microfluídico para superar os limites existentes, acoplando diretamente a separação no chip à análise no chip e ao dimensionamento molecular. O recurso de design permitiu a análise de uma fração específica, ajustando a intensidade do campo aplicado. Eles projetaram o dispositivo para identificar frações separadas semelhantes aos métodos SEC-MALS (cromatografia de exclusão de tamanho com espalhamento de luz em múltiplos ângulos) ou LC (chip) -MS ((on-chip) -líquido cromatografia-espectrometria de massa).
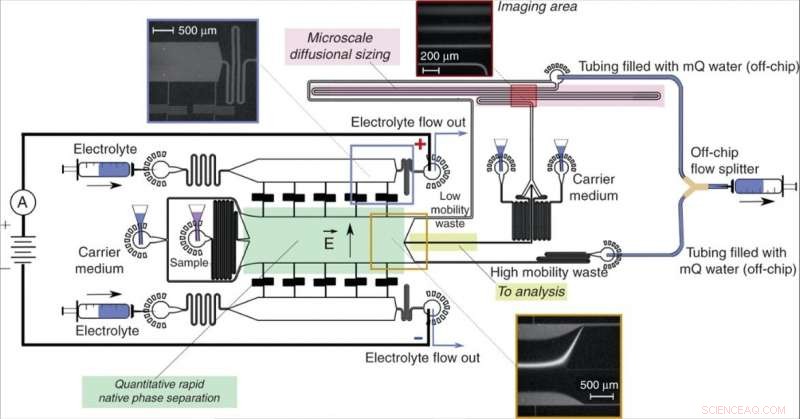
Projeto e operação do dispositivo. Uma unidade de eletroforese de fluxo livre (verde), permitindo a rápida separação de moléculas de analito em sua fase nativa e produzindo informações quantitativas sobre o processo de separação, frações direcionadas da amostra (amarelo) para um processo de análise a jusante envolvendo dimensionamento difusional microfluídico (MDS; rosa). A amostra foi caracterizada pelo monitoramento de um único quadro de imagem (inserção superior direita) para extrair simultaneamente os tamanhos e as cargas das frações separadas. O dispositivo foi operado aplicando uma pressão negativa em sua saída com um divisor de fluxo fora do chip em forma de Y, mantendo as soluções dos canais de “resíduos de baixa mobilidade” e “resíduos de alta mobilidade” separados para evitar curto-circuito parcial do dispositivo. O potencial elétrico foi aplicado a partir das saídas da solução eletrolítica, empregando uma solução eletrolítica em fluxo conforme descrito anteriormente13. O fluxo da solução eletrolítica, que incluiu um marcador fluorescente para sua visualização, foi escolhido de forma que o eletrólito alcançasse sua saída em vez de ser retirado para a câmara de separação sem alcançá-lo (inserção superior esquerda), ainda assim, vazaria para a câmara por uma distância controlada, deixando espaço suficiente para desviar o feixe de amostra (inserção inferior). Crédito:Microsystems &Nanoengineering, doi:10.1038 / s41378-019-0072-3
O dispositivo tinha o benefício adicional de realizar todo o processo totalmente arraigado para a separação eletroforética em solução livre, permitindo que os pesquisadores obtenham um mapa quantitativo em poucos minutos - muito mais rápido do que as técnicas convencionais. A mistura não foi afetada pelo meio de suporte, e os pesquisadores puderam estudar interações moleculares fracas e não covalentes.
Saar et al. projetou o dispositivo usando uma unidade de eletroforese quantitativa de fase nativa conectada a uma unidade de dimensionamento de dispositivo difusional microfluídico (MDS). A plataforma combinada permitiu componentes de mobilidade eletroforética específica (µ e1 ) para análise downstream no chip, em função da intensidade do campo elétrico aplicado. Eles projetaram três canais a jusante da unidade de eletroforese para manter os produtos da eletrólise longe do chip, sem entrar no dispositivo. Eles minimizaram o número de unidades individuais que direcionaram o fluxo no dispositivo, acoplado à operação estável do dispositivo para caracterização quantitativa da amostra. Os cientistas mantiveram as saídas do eletrólito separadas do dispositivo combinado para aplicar potencial elétrico em todo o dispositivo sem gerar um curto-circuito elétrico, e para permitir a remoção eficiente de qualquer produto de eletrólise sem acúmulo para evitar flutuações de pressão.
A equipe de pesquisa aplicou o potencial elétrico em conectores metálicos para gerar uma interface de metal e fluido fora do chip de acordo com o protótipo de dispositivo projetado pela mesma equipe. Nesse trabalho, Saar et al. projetou um divisor de fluxo em forma de Y e manteve os fluxos separados até que eles alcançassem o divisor para evitar curto-circuito parcial. Eles calcularam a taxa de fluxo do eletrólito no dispositivo para ter um efeito no desempenho do dispositivo.
(a) A voltagem aplicada através da câmara de eletroforese foi ajustada em etapas lineares para direcionar frações específicas para análise. (b) As frações foram então dimensionadas por imagem da unidade de dimensionamento difusional consistindo em quatro canais nos quais a extensão da difusão das moléculas de analito em seu tampão transportador circundante foi monitorada. (c) O tamanho médio das moléculas de analitos em cada uma das frações foi encontrado ajustando os perfis fluorescentes observados para diferentes raios hidrodinâmicos (Rh) e minimizando o menor erro quadrático médio entre o ajuste (linha pontilhada vermelha) e os dados (azul linha contínua). (d) A intensidade de fluorescência na área de análise variou dependendo da concentração dos analitos em cada uma das frações (topo) e os tamanhos dos componentes em uma mistura binária de lisozima e albumina sérica bovina foram encontrados como sendo Rh =1,9 nm e Rh =3,6 nm (parte inferior). (e) Esta mistura binária não pode ser caracterizada usando técnicas de dimensionamento que não envolvem etapas de pré-fracionamento, como dispersão de luz dinâmica (DLS; linha pontilhada em azul claro). Seu dimensionamento foi possível utilizando o dispositivo descrito neste trabalho (linha contínua azul escuro). Crédito:Microsystems &Nanoengineering, doi:10.1038 / s41378-019-0072-3 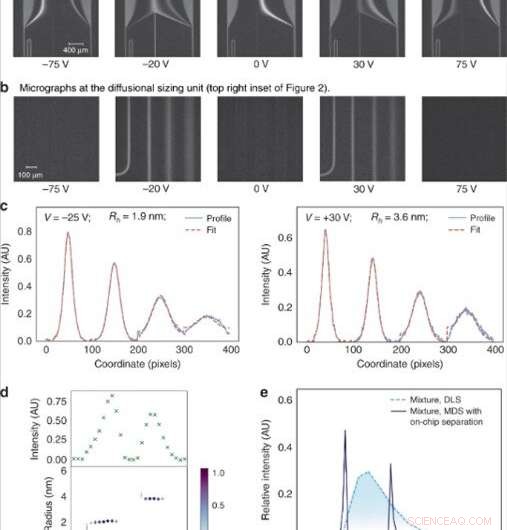
Eles fotografaram o bocal no qual a amostra encontrou o meio transportador como um ponto de referência no movimento das partículas. Os cientistas ajustaram o canal de dimensionamento difusional ou a taxa de fluxo para dimensionar com precisão as moléculas de analito, ordens de magnitudes maiores ou menores em tamanho. Uma vez que eles projetaram a plataforma microfluídica usando poli (dimetilsiloxano) (PDMS), os cientistas eliminaram qualquer autofluorescência na configuração antes de analisar os dados da imagem.
Eles então usaram o dispositivo para analisar uma mistura binária de proteínas de amostra; albumina de soro bovino e lisozima humana. Para preservar os estados nativos das moléculas de proteína, eles criaram imagens das amostras sem rótulo com um microscópio caseiro baseado em comprimento de onda de UV e quantificaram a fluorescência intrínseca da amostra. Saar et al. confirmou a capacidade de separar a mistura em seus componentes, aplicando primeiro um conjunto de voltagens para registrar os perfis fluorescentes. Eles então registraram as mobilidades eletroforéticas das proteínas (µ e1 ) combinada com a taxa de fluxo no dispositivo para caracterizar a maioria das proteínas e seus complexos. Os cientistas alteraram a taxa de fluxo ou a voltagem aplicada para analisar biomoléculas com diversos parâmetros biofísicos.
Usando a plataforma, eles rapidamente caracterizaram misturas de moléculas em nanoescala, onde analitos individuais mostraram tamanhos semelhantes, mas diversas propriedades eletroforéticas. Com base no histograma resultante, a equipe de pesquisa confirmou a presença de duas amostras distintas. Comparativamente, em uma abordagem de separação convencional fora do chip, a última etapa exigia o fracionamento por transferência de amostra de uma ferramenta analítica para outra por meio de tubos interconectados, limitar o desempenho do dispositivo. A concentração total de proteína no estudo foi de aproximadamente 100 µM e os cientistas detectaram com precisão o limite de sensibilidade de aproximadamente 100 nM, em relação à fluorescência intrínseca das frações proteicas. Para compostos opticamente não ativos, Saar et al. sugerem uma estratégia alternativa de detecção e caracterização, como detecção de massa seca.
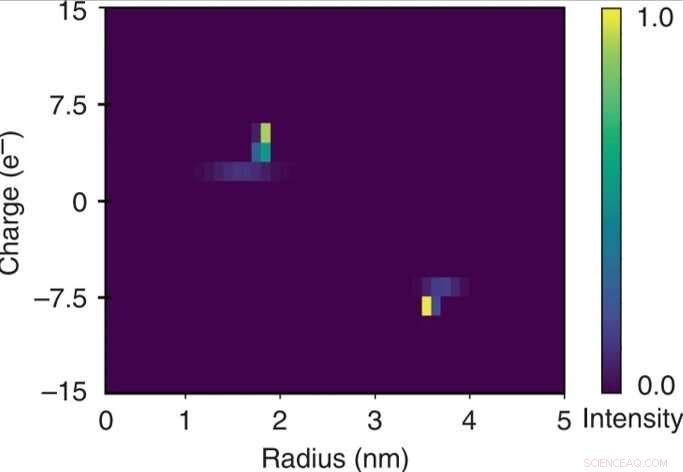
Caracterização bidimensional rápida de uma mistura de albumina de soro bovino e lisozima humana. A natureza quantitativa da unidade de separação eletroforética permitiu que o potencial aplicado fosse relacionado à mobilidade eletroforética μel de cada uma das frações. Esses dados foram usados em combinação com os raios hidrodinâmicos extraídos (Rh) para estimar as cargas efetivas (q) das moléculas em cada uma das frações e para construir um mapa bidimensional q vs Rh da mistura ao longo de uma escala de tempo de alguns minutos por monitorar o dispositivo apenas em um único quadro de imagem. Crédito:Microsystems &Nanoengineering, doi:10.1038 / s41378-019-0072-3
Saar et al. usou a estratégia para obter mapas de características bidimensionais (2-D) da mistura de proteínas como uma prova de conceito. Eles extraíram informações quantitativas da etapa de separação e relacionaram os potenciais aplicados às mobilidades eletroforéticas das espécies para estimar a eficácia do dispositivo. Eles registraram a corrente que flui no sistema durante a operação normal e quando a câmara de separação foi curto-circuitada para estimar a resistência elétrica total do dispositivo e dos eletrodos.
Os pesquisadores calcularam a mobilidade eletroforética como o movimento de uma partícula em um campo elétrico para cada uma das frações. Com base nos dados experimentais, o mapa característico 2-D construído incluiu a carga efetiva (q) e o raio hidrodinâmico (Rh) da mistura. As unidades de carga elementares resultantes das proteínas específicas concordam com os valores estimados em outros lugares. Eles obtiveram o mapa bidimensional completo monitorando apenas um único quadro de imagem para uma análise rápida da solução.
O tempo analítico do dispositivo de microfluídica desde a separação até o dimensionamento difusional e a geração de imagens foi de aproximadamente 14 segundos. Os cientistas construíram o mapa experimental 2-D usando apenas 3 µL de amostra ao longo de sete minutos no total, ordens de magnitude mais rápido do que a escala de tempo para realizar géis de proteína 2-D convencionais. A equipe de pesquisa conduziu uma ampla gama de interações biomoleculares, em solução, diretamente sob condições nativas que antes eram difíceis de executar no laboratório.
Desta maneira, Kadi L. Saar e colegas de trabalho desenvolveram um dispositivo microfluídico que combina a separação no chip com a análise direta no chip para substituir as abordagens convencionais existentes em microescala. Usando o dispositivo, eles analisaram rapidamente uma mistura binária de proteínas que não podiam ser identificadas como componentes individuais por meio de abordagens de dimensionamento de solução existentes. Eles construíram um mapa 2-D característico da mistura heterogênea em uma escala de tempo rápida para abrir a possibilidade de caracterização da proteína em solução em uma resolução de tempo sem precedentes em comparação com as técnicas biofísicas existentes.
© 2019 Science X Network