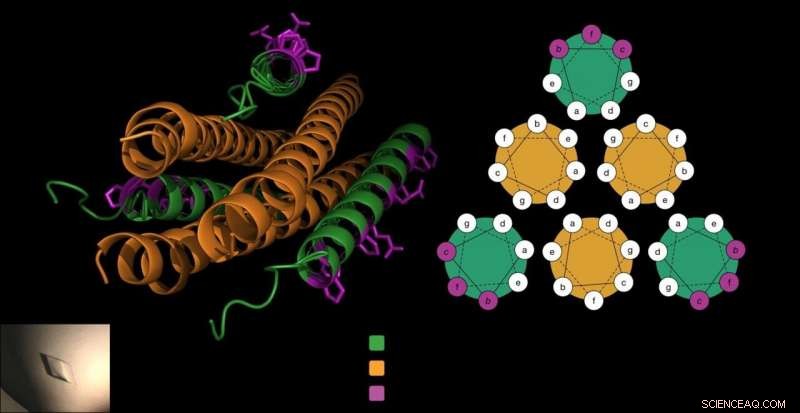
O peptídeo antiviral é composto por três saca-rolhas (em verde), que bloqueiam em torno da proteína de fusão do vírus (em laranja) para impedir que o vírus entre nas células. O laboratório Gellman adicionou beta aminoácidos exclusivos ao peptídeo (em roxo) de uma forma que não interferiu com essa interação crucial e tornou o peptídeo mais estável. Crédito:Victor Outlaw.
Ao criar um pequeno pedaço de proteína, ou peptídeo, que pode prevenir a ligação do vírus parainfluenza humano às células, os pesquisadores aprimoraram um método em modelos de roedores com o objetivo de ajudar a manter as crianças saudáveis.
Vírus da parainfluenza humana, ou HPIVs, são a principal causa de infecções respiratórias na infância, responsável por 30% a 40% das doenças como crupe e pneumonia. Os vírus também afetam idosos e pessoas com sistema imunológico comprometido.
Para adoecer as pessoas, Os HPIVs devem se agarrar às células e injetar seu material genético para começar a produzir novos vírus. O HPIV3 é o mais prevalente entre esses vírus. Atualmente, não existem vacinas ou antivirais aprovados para a infecção pelo HPIV3 em pessoas.
Em um estudo conduzido pelo laboratório Sam Gellman no departamento de química da Universidade de Wisconsin-Madison, e o laboratório de Anne Moscona e Matteo Porotto na Universidade de Columbia, pesquisadores construíram anos de trabalho em tratamentos com peptídeos para gerar um capaz de bloquear o processo de fixação do HPIV3.
Os pesquisadores publicaram suas descobertas em 7 de abril no Jornal da American Chemical Society .
Para entrar nas células hospedeiras, Os HPIVs usam proteínas de fusão especializadas que se assemelham a três saca-rolhas colocados lado a lado. Um trabalho anterior do laboratório Moscona-Porotto mostrou que os cientistas conseguiram uma parte parcial desta proteína saca-rolhas do HPIV3, introduzir este peptídeo ao vírus, e evitar que o saca-rolhas conduza o processo de infecção. O peptídeo, em si um saca-rolhas, essencialmente fecha com os saca-rolhas do vírus, criando um feixe compacto de seis formas de saca-rolhas.
O novo peptídeo persiste por mais tempo no corpo, tornando-o cerca de três vezes mais eficaz no bloqueio da infecção em modelos de roedores da doença do que a forma original.
A equipe de pesquisa começou tentando desenvolver o peptídeo original para ser mais resistente às enzimas digestivas de proteínas no corpo, que pode facilmente destruir proteínas e torná-las inúteis. Então, o laboratório Gellman recorreu a blocos de construção incomuns para criar um peptídeo mais resistente.
As células constroem proteínas a partir de alfa-aminoácidos. Mas os químicos podem criar beta-aminoácidos, que são semelhantes, mas têm um átomo de carbono extra. Quando os peptídeos usam esses blocos de construção de aminoácidos beta, muitas vezes assumem uma forma diferente por causa do átomo extra. Isso pode ajudar um peptídeo a se esconder das enzimas que digerem proteínas e a sobreviver por mais tempo.
Contudo, os pesquisadores também sabiam que se a forma do peptídeo mudasse muito como resultado desses blocos de construção incomuns, eles podem não travar juntos com a proteína de fusão saca-rolhas do HPIV.
É aí que as décadas de experiência do laboratório Gellman testando e modificando peptídeos contendo aminoácidos beta se tornaram críticas.
“Nós sabemos qual lado do peptídeo está se ligando à sua proteína alvo. nós (sabíamos que) podemos modificar apenas os resíduos que não estão diretamente envolvidos na ligação da proteína viral, "diz Victor Outlaw, um pesquisador de pós-doutorado no laboratório e um dos co-autores do relatório. Em testes de laboratório, eles viram que o peptídeo cuidadosamente modificado ainda se ligava fortemente à proteína do vírus.
Em outra melhoria iniciada pelo laboratório Moscona-Porotto, os cientistas ligaram o peptídeo a uma molécula de colesterol. Esta adição de gordura ajuda o peptídeo a deslizar para a membrana celular gordurosa, onde pode bloquear melhor o vírus.
"Nossa hipótese era que a combinação de beta aminoácidos e colesterol aumentaria a eficácia antiviral, "diz Outlaw, que explicou que o colesterol ajudou a levar o peptídeo para onde precisava ir, enquanto a mudança de forma dos aminoácidos beta permitiu que o peptídeo persistisse por mais tempo no corpo.
Como a equipe de pesquisa esperava, quando deram o novo peptídeo aos ratos do algodão, ele durou muito mais tempo nos pulmões do que a versão anterior, graças à sua resistência à digestão por enzimas. O peptídeo foi entregue no nariz dos ratos.
Para testar o quão bem o peptídeo funcionou para prevenir a infecção, ratos do algodão receberam o novo peptídeo antes de serem expostos ao HPIV3. Em comparação com animais que não receberam peptídeos antivirais, aqueles que receberam o peptídeo melhorado tinham 10 vezes menos vírus em seus pulmões.
E em comparação com o peptídeo que era mais suscetível a enzimas, o peptídeo mais resistente reduziu a carga viral em cerca de três vezes, sugerindo que a capacidade do novo peptídeo de evitar a digestão no corpo ajuda a bloquear melhor a infecção.
Embora a abordagem ainda não tenha sido testada em humanos e os pesquisadores devam refinar e testar o sistema, ele fornece uma nova estratégia para potencialmente prevenir ou tratar essas infecções comuns.
A colaboração de pesquisa agora está procurando fazer peptídeos de segunda geração que durem ainda mais no corpo. Eles também querem testar o quão bem o peptídeo modificado pode bloquear a infecção por vírus relacionados. Essa pesquisa adicional pode levar o tratamento com peptídeo mais perto de ensaios clínicos.
"Foi uma sorte reunir grupos que tinham necessidades e capacidades complementares, "diz Gellman." É realmente um grande esforço conjunto. "