
A lisencefalia-1, ou proteína Lis1, ativa o motor dineína para que possa transportar carga celular. O dinein alterna entre "desligado" (esquerda) e "ligado" (direita). Lis1 se liga à dineína quando está ligada, evitando que a dineína mude para um estado "desligado". Crédito:Markus Lab / Colorado State University
Movimento sinaliza vida, e em nenhum lugar isso é mais verdadeiro do que dentro de uma célula viva. Os milhões de proteínas e moléculas dentro de cada uma de nossas células se dobram, viajar e se conformar em um padrão complexo, mas orquestrado, regulado pelos genes que codificam o que vai, onde e quando. Como parte desse padrão, uma importante classe de proteínas chamada dineína transporta e distribui várias cargas celulares entre diferentes áreas da célula.
O pesquisador de bioquímica da Universidade Estadual do Colorado, Steven Markus, está particularmente intrigado com esses grandes, proteínas motoras intracelulares que se movem metodicamente ao longo de uma rede de trilhas filamentosas chamadas microtúbulos.
Qual a importância da dineína? Se dinein desaparecesse, não viveríamos além de algumas divisões celulares mitóticas. E muitas doenças neurológicas, incluindo um chamado lissencefalia, estão ligados a defeitos na função dineína. O objetivo de muitos laboratórios, incluindo Markus ', é entender o porquê.
Sua equipe de pesquisa deu um salto nesse entendimento ao revelar, em detalhes intrincados, o mecanismo pelo qual uma molécula específica afeta a função da dineína. Embora se soubesse que o gene lissencefalia-1, ou Lis1, afeta a atividade da dineína, os detalhes não eram claros. Markus e sua equipe revelaram exatamente como Lis1 ativa a dineína, impedindo a capacidade da dineína de se desligar, estabilizando-o em uma "abertura, "conformação desinibida.
A nova descoberta vai contra os pontos de vista previamente aceitos de que Lis1 agia como um inibidor da dineína. De acordo com o novo estudo do laboratório Markus, publicado em 27 de abril em Nature Cell Biology , o oposto é verdadeiro:Lis1 ativa dineína, trabalhando para se firmar de tal forma que a proteína motora seja impedida de se dobrar em um estado "desligado" - inibindo sua capacidade de auto-inibir, os pesquisadores explicam.
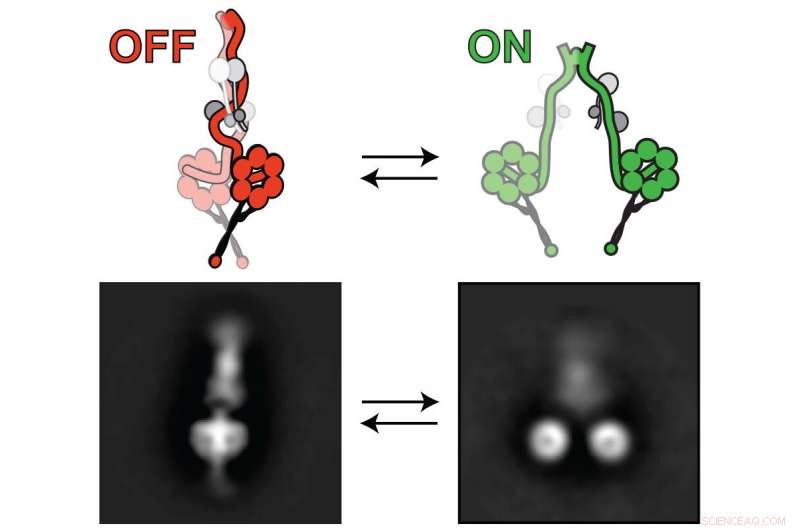
Os pesquisadores usaram uma combinação de técnicas de ponta para tirar suas conclusões, incluindo microscopia eletrônica de alta resolução. Eles usaram isso para visualizar o motor dineína em seus estados "desligado" (à esquerda) e "ligado" (à direita). Crédito:Markus Lab / Colorado State University
Compreendendo a base molecular da doença
Uma pessoa com lisencefalia, ou "cérebro liso, "sofre convulsões e limitação da função motora e raramente vive depois de alguns anos de idade. Esta doença devastadora está associada a uma mutação em Lis1, um gene que codifica um regulador crítico da dineína.
"Estou interessado na base molecular dessas doenças, "disse Markus, professor assistente do Departamento de Bioquímica e Biologia Molecular. "Não haverá intervenções terapêuticas sem a compreensão de como essas moléculas funcionam." Além disso, Markus diz, "motores moleculares são divertidos, porque podemos purificar esses motores e vê-los andar sobre microtúbulos em tempo real usando microscopia de fluorescência "- que é exatamente o que a equipe fez para o estudo.
Para realizar seus experimentos, os pesquisadores empregaram células de levedura brotando como sistema modelo. Em contraste com as células humanas nas quais a dineína realiza inúmeras atividades, A dineína desempenha apenas uma única função nessas células. Suas descobertas com este sistema simplificado podem se traduzir em células humanas e outras células eucarióticas superiores, em que a função dineína básica é preservada ao longo de milhões de anos de evolução.
Os pesquisadores empregaram várias técnicas para tirar suas conclusões. O mais importante era a imagem de molécula única em tempo real. Usando uma técnica de alto rendimento que desenvolveram no laboratório, a equipe purificou dineína, adicionado uma molécula fluorescente, e câmaras de imagem de microscópio montadas com microtúbulos purificados para observar a dineína "passar rapidamente, "Disse Markus. Esta técnica permitiu-lhes estabelecer o papel da conformação auto-inibida na motilidade da dineína.
Eles também usaram microscopia eletrônica para tirar fotos de alta resolução para determinar se as moléculas de dineína realmente adotaram uma conformação auto-inibida, o que não estava claro quando eles começaram seu estudo. "No primeiro dia na instalação de microscopia eletrônica, ficamos muito surpresos ao ver que as moléculas de dineína estavam inequivocamente em uma conformação auto-inibida, "Markus disse." Tinha uma forma bem distinta.
O autor principal do estudo foi o ex-aluno de graduação Matthew Marzo (agora um pesquisador de pós-doutorado na Universidade de Columbia), quem projetou e liderou os experimentos, com assistência da co-autora e então estudante de graduação Jacqueline Griswold (agora estudante de Ph.D. e pesquisadora de pós-graduação da NSF na Johns Hopkins School of Medicine).
Markus planeja conduzir outros experimentos, usando as mesmas células de levedura, para investigar melhor o papel de Lis1 no que ele e seus colegas pensam ser uma via de várias etapas que ativa a dineína. Ele também espera trabalhar com neurocientistas da CSU para determinar se o mecanismo de ativação Lis1 funciona de maneira semelhante nos neurônios. Lá, o objetivo será fornecer ainda mais conhecimento sobre como as doenças cerebrais, como a lissencefalia, ocorrem em nível molecular.
O estudo é intitulado:"Pac1 / LIS1 estabiliza uma conformação desinibida de dineína para coordenar sua localização e atividade."