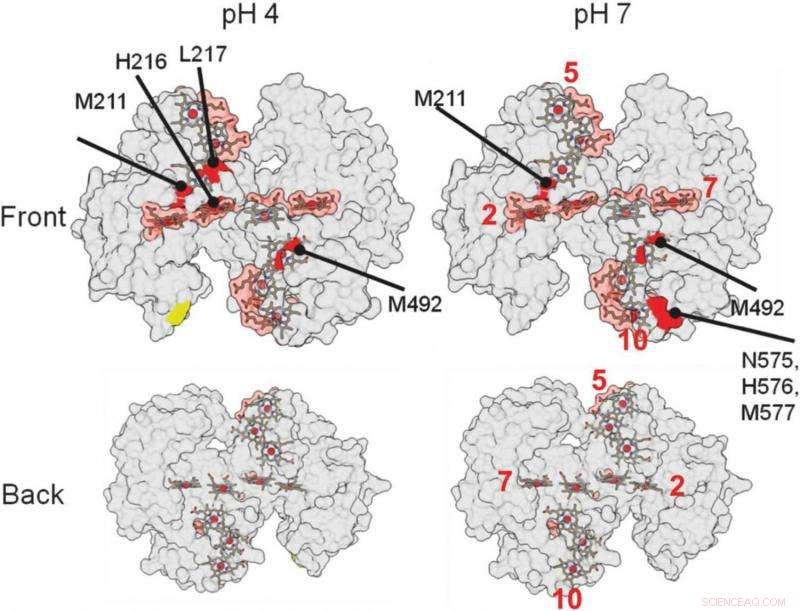
nessas representações estruturais 3-D da proteína, ajudou os pesquisadores a identificar onde a proteína se liga a um mineral. As áreas vermelhas indicam possíveis áreas de encadernação. Crédito:Berkeley Lab
Os cientistas descobriram os detalhes de um acoplamento não convencional entre uma proteína bacteriana e um mineral que permite à bactéria respirar quando o oxigênio não está disponível.
A pesquisa, conduzido por uma equipe de cientistas do Laboratório Nacional Lawrence Berkeley do Departamento de Energia (Berkeley Lab), pode levar a novas inovações na ligação de proteínas a outros materiais para dispositivos eletrônicos de base biológica - como sensores que podem diagnosticar doenças ou detectar contaminantes. Também pode ajudar os pesquisadores a compreender e controlar as reações químicas desencadeadas por essas interações proteína-material.
"Mover elétrons para metais pode fazer com que diferentes minerais cresçam ou se dissolvam. Estudar como uma proteína faz isso pode nos ajudar a entender como os organismos remodelam seu ambiente e fazem biominerais para os dentes ou proteção, "disse Caroline Ajo-Franklin, um cientista da equipe da Instalação de Nanoestruturas Biológicas da Fundição Molecular do Berkeley Lab, que é um centro de pesquisa em nanociências.
Ajo-Franklin liderou o estudo, publicado online no Jornal da American Chemical Society no início deste mês.
"Compreender como são essas interações entre proteínas e materiais pode nos ajudar a projetá-los melhor, " ela adicionou, "e nos dá uma visão sobre como conectar células vivas com dispositivos."
Os pesquisadores confiaram em uma técnica baseada em raios-X na fonte de luz avançada do Berkeley Lab (ALS), conhecido como "pegada, "para localizar as conexões químicas entre a proteína bacteriana e as nanopartículas compostas de ferro e oxigênio.
O estudo, que identificou um sítio de ligação surpreendentemente pequeno e fraco, também se beneficiou de ferramentas e experiência na Fundição Molecular do Laboratório; e o Joint BioEnergy Institute conduzido por laboratório, especializada em pesquisa em biocombustíveis.
A estrutura desta proteína exótica foi previamente mapeada de forma isolada com detalhes em escala atômica por outros grupos de pesquisa usando cristalografia de raios-X, que exigia uma forma cristalizada da proteína. Mas os cientistas não sabiam como ele se ligava ao mineral que contém o metal - as técnicas convencionais não conseguem ver esse processo de ligação.

Sayan Gupta, um especialista em pegadas de raios-X, demonstra um tipo de porta-amostra que foi usado para estudar como uma proteína se liga a um mineral. Crédito:Paul Mueller
Em 2014, Ajo-Franklin aprendeu com Corie Ralston, outro pesquisador de laboratório que trabalha na Divisão de Biofísica Molecular e Bioimagem Integrada (MBIB), sobre a técnica de pegada de espectrometria de massa de raios-X, uma forma inovadora de sondar com precisão proteínas e seus arredores com raios-X no ALS.
Ajo-Franklin e Ralston estavam, cada um, buscando projetos separados de Pesquisa e Desenvolvimento Dirigidos por Laboratório, e eles viram que os dois esforços poderiam realmente ser complementares.
Ralston havia adotado a técnica de pegada de raios-X de seu ex-orientador, Mark Chance, um professor da Case Western Reserve University que estabeleceu a técnica de impressão de raios-X no Laboratório Nacional de Brookhaven em Long Island, N.Y. Esta técnica de raios-X está disponível apenas no ALS e na Fonte de Luz Síncrotron Nacional II de Brookhaven (NSLS-II).
"A pegada pode dizer como as proteínas estão interagindo, "Ralston disse." Ele pode fornecer informações estruturais e dinâmicas sobre proteínas próximas ao seu ambiente nativo. "
A proteína selecionada para o estudo é de uma bactéria redutora de metal, Shewanella oneidensis, que "come açúcar e basicamente respira minerais" quando o oxigênio não está disponível, Ajo-Franklin observou. "Uma das razões pelas quais esses organismos são tão divertidos de estudar é que eles interagem com uma ampla variedade de materiais."
Depois de Tatsuya Fukushima, um ex-cientista de laboratório que foi co-autor do estudo, encontraram uma maneira adequada de preparar a proteína e nanopartículas em uma solução líquida para estudos de raios-X, Sayan Gupta, um especialista em pegadas de raios-X na Divisão MBIB do Berkeley Lab, usou uma linha de luz de raios-X no ALS para estudar as amostras.
"Estamos captando instantâneos do estado dessa molécula em um determinado momento, "Gupta disse." É uma técnica simples e fornece muitas informações sobre o estado nativo de uma proteína. "
Nesta técnica, Os raios X produzem moléculas altamente reativas conhecidas como radicais hidroxila à medida que passam pela solução líquida que envolve a proteína. Esses radicais modificam a proteína de uma forma que permite aos cientistas localizar pequenas variações químicas onde a proteína está em contato com a solução.
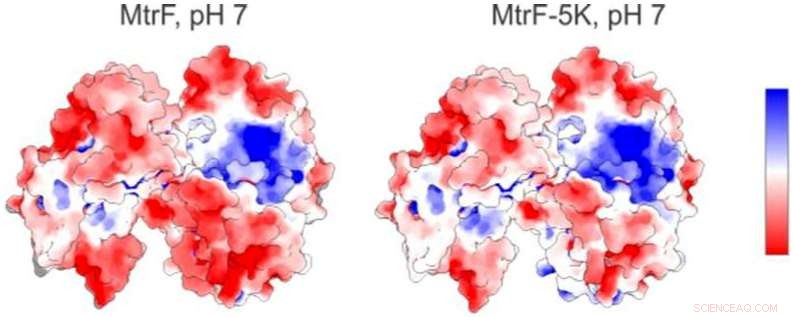
Um mapa eletrostático (à esquerda) de uma proteína estudada na Fonte de Luz Avançada do Berkeley Lab mostra regiões carregadas positivamente (azul) e negativamente (vermelho). À direita está um mapa eletrostático previsto para uma forma mutante da proteína. Crédito:Berkeley Lab
As regiões da proteína que estão interagindo com outras proteínas ou materiais são protegidas dos radicais e não estão sujeitas às alterações químicas. Os locais onde a proteína não é alterada indicam onde ocorre a ligação.
No último estudo, esses instantâneos químicos produzidos pela técnica de pegada de raios-X em diferentes pontos no tempo foram posteriormente analisados usando uma técnica conhecida como espectrometria de massa no Joint BioEnergy Institute.
Uma análise detalhada de Fukushima revelou como a proteína se conectava ao mineral.
"A maior descoberta, isso foi bastante surpreendente, foi que nossas proteínas se ligam de forma relativamente fraca, "Ajo-Franklin disse." A maioria das proteínas que fazem interface com os materiais se ligam muito fortemente, "mudando de forma à medida que formam esta conexão. Esta proteína em particular não parece mudar de forma e apenas interage com o mineral em uma pequena área, exigindo cerca de cinco vezes menos energia de ligação, por comparação, do que proteínas típicas que formam biominerais.
Isso realmente faz muito sentido, ela adicionou. "O trabalho dessa proteína é transferir elétrons para o mineral, então não precisa ficar em contato por muito tempo. "
A equipe de pesquisa agora está trabalhando para estudar como essa proteína e outras semelhantes interagem com uma variedade de minerais.
"Há um monte de proteínas nesta família, "Ajo-Franklin disse." Estamos muito animados para ver como essas proteínas interagem com diferentes materiais. Todos eles usam a mesma estratégia de vinculação? "
Este estudo já fornece ideias sobre como redesenhar essas proteínas para fazer melhores conexões eletrônicas e, portanto, sensores bioeletrônicos mais sensíveis - um projeto em que Ajo-Franklin está trabalhando.