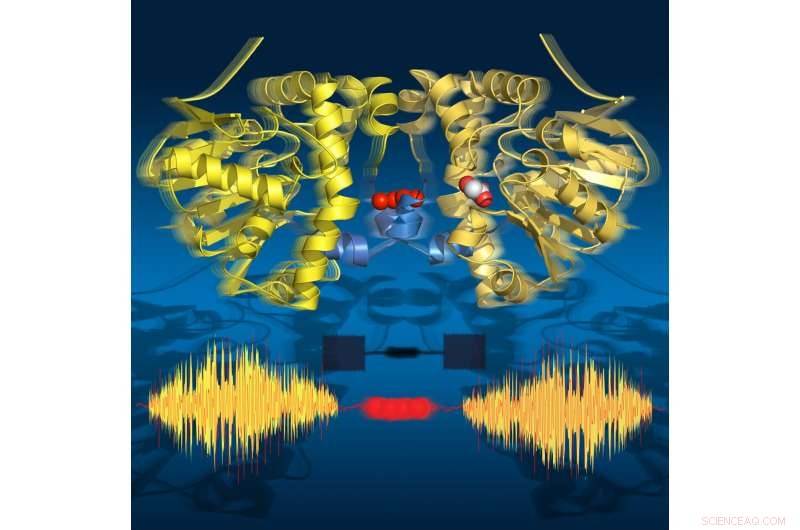
 p Imagens de lapso de tempo mostram que a enzima "respira" durante o turnover:ela se expande e se contrai alinhada com as subetapas catalíticas. Suas duas metades se comunicam por meio de uma cadeia de moléculas de água. Crédito:Joerg M. Harms, MPSD
p Imagens de lapso de tempo mostram que a enzima "respira" durante o turnover:ela se expande e se contrai alinhada com as subetapas catalíticas. Suas duas metades se comunicam por meio de uma cadeia de moléculas de água. Crédito:Joerg M. Harms, MPSD
p Pesquisadores do Departamento de Dinâmica Resolvida Atomicamente do Instituto Max Planck para a Estrutura e Dinâmica da Matéria (MPSD) no Centro de Ciência do Laser de Elétrons Livres em Hamburgo, a Universidade de Potsdam (ambas na Alemanha) e a Universidade de Toronto (Canadá) montaram um filme de lapso de tempo detalhado, revelando todas as etapas principais durante o ciclo catalítico de uma enzima. Surpreendentemente, a comunicação entre as unidades de proteína é realizada por meio de uma rede de água semelhante a um fio de telefone. Esta comunicação está alinhada com um movimento de 'respiração', essa é a expansão e contração da proteína. Essa sequência de estruturas com lapso de tempo revela os movimentos dinâmicos como um elemento fundamental nas bases moleculares da biologia. p Toda a vida é dinâmica, assim como seus blocos de construção moleculares. Os movimentos e mudanças estruturais das biomoléculas são fundamentais para suas funções. Contudo, compreender esses movimentos dinâmicos em um nível molecular é um desafio formidável. Como uma proteína é capaz de acelerar uma reação química, o que levaria anos para prosseguir sem ajuda?
p Para isso, os pesquisadores recorreram a uma enzima que divide a ligação simples mais forte da química orgânica:a ligação C-F. Os carbonos fluorados podem ser encontrados em materiais como Teflon ou GoreTex e em muitos produtos farmacêuticos e pesticidas. Os compostos fluorados têm uma influência particular nas mudanças climáticas, excedendo a eficácia do CO
2 por ordens de magnitude. Portanto, a capacidade de compreender melhor e, eventualmente, controlar o giro dos títulos C-F é de particular interesse para as mudanças climáticas e a biorremediação.
p Os pesquisadores usaram cristalografia de raios-X resolvida no tempo para tirar instantâneos moleculares durante a reação de turnover desta enzima natural em temperaturas fisiológicas. Este filme de lapso de tempo revelou dezoito pontos no tempo de 30 milissegundos a 30 segundos, cobrindo todos os principais estados catalíticos que levam à quebra da ligação C-F. Surpreendentemente, o filme também mostra que a enzima "respira" durante a rotação, ou seja, ele se expande e se contrai de acordo com as subetapas catalíticas.
p Surpreendentemente, as duas metades da enzima se comunicam por meio de uma cadeia de moléculas de água que conecta as duas metades. Essa rede de água permite que as duas metades "conversem" uma com a outra e compartilhem informações sobre seu estado catalítico. Isso é crucial para a função da enzima, pois apenas metade da enzima pode estar ativa em um determinado momento.
p Essas mudanças dinâmicas têm se mostrado cruciais para a função da enzima. Os pesquisadores esperam que muitos outros sistemas explorem mecanismos semelhantes para suas atividades.
