
Experiência de luz solar. As reações podem ser realizadas utilizando a luz do sol em um frasco de vidro simples. Crédito:J. Waser / EPFL
A descoberta de novos alvos biológicos é uma parte crítica de nossa batalha contínua contra as doenças. Ao longo dos anos, os cientistas fizeram progressos impressionantes na compreensão dos sistemas biológicos, identificar constantemente novos alvos. A diversidade estrutural desses alvos requer uma ampla gama de diferentes agentes terapêuticos.
"Pequenas moléculas sintéticas ainda são peças-chave, mas biomoléculas, como peptídeos, proteínas e oligonucleotídeos tornaram-se uma importante área de pesquisa, "diz o professor Jérôme Waser, diretor do Laboratório de Catálise e Síntese Orgânica da EPFL. Os peptídeos são particularmente interessantes, com cerca de 140 avaliados em ensaios clínicos em 2015. No entanto, peptídeos muitas vezes não são estáveis no sangue e não podem permear bem as células, ambos diminuem seu uso potencial como drogas.
Uma solução para superar essas dificuldades é modificar quimicamente a estrutura natural dos peptídeos, um processo denominado "funcionalização". Na quimica, uma molécula é "funcionalizada" pela adição de grupos químicos a ela, assim, dotando-o de novas funções, capacidades, ou propriedades, como maior estabilidade no corpo humano. Contudo, funcionalização de peptídeos é difícil, devido à sua estrutura complexa.
"O principal motivo é a falta de seletividade quando você tenta modificar um peptídeo:ele contém muitas posições que reagem com produtos químicos, resultando em misturas inúteis, "explica Waser." Portanto, métodos que permitem a funcionalização seletiva de uma única posição em peptídeos são ativamente procurados para acessar drogas baseadas em peptídeos estáveis mais eficientes. "
Isso é o que o laboratório de Waser conseguiu agora, usando "reagentes EBX" - uma classe de compostos orgânicos muito reativos desenvolvida pelo grupo e agora disponível comercialmente. Usando esses reagentes, os pesquisadores converteram o ácido carboxílico C-terminal dos peptídeos em uma ligação tripla carbono-carbono - um alcino (no jargão químico, uma "alcinilação descarboxilativa"). A porção alcino é um grupo funcional muito valioso que pode ser usado para modificar ainda mais os peptídeos. Tem sido usado extensivamente na descoberta de drogas, ciências dos materiais e biologia química.
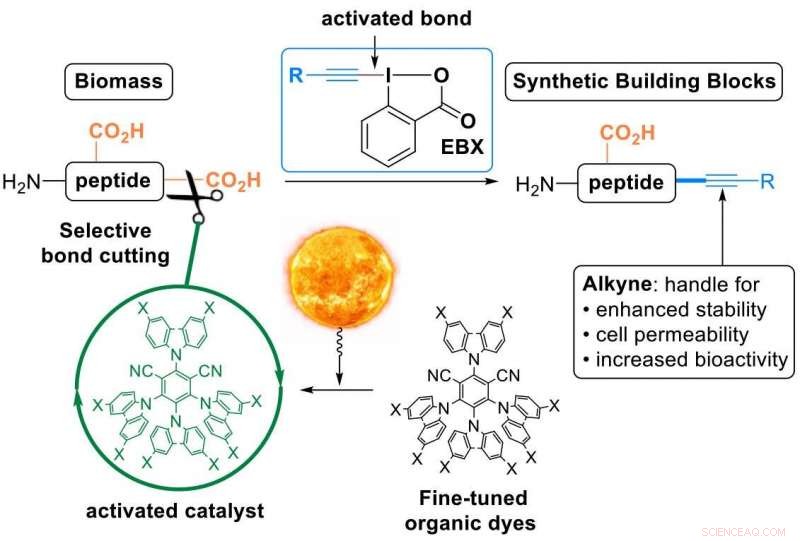
Unindo o mundo natural e o sintético em uma única etapa:Modificação de peptídeos usando corantes orgânicos excitados com luz visível e reagentes EBX. Crédito:J. Waser / EPFL
Os peptídeos não reagem espontaneamente com os reagentes EBX, então os cientistas tiveram que usar um catalisador. Para ativá-lo, os pesquisadores se voltaram para a luz ou, em termos mais técnicos, "catálise fotoredox":a luz visível é absorvida pelo catalisador, que então ativa seletivamente uma ligação nas moléculas reagentes. “Usar a luz como fonte de energia renovável para realizar reações orgânicas permite uma resolução temporal e espacial com condições de reação muito suaves, "diz Waser.
Os pesquisadores fizeram duas inovações:primeiro, eles projetaram novos corantes orgânicos ajustados como catalisadores fotorredox. Isso foi importante porque as reações mediadas pela luz são baseadas geralmente em raras, catalisadores de metais de transição tóxicos e caros.
Segundo, os pesquisadores alcançaram esta primeira "alcinilação descarboxilativa" em peptídeos nativos. Esta é uma transformação em uma etapa especialmente atraente de um composto natural em um derivado sintético, pois oferece uma plataforma para modificar as propriedades físicas e químicas do peptídeo por meio de um único, manipulação fácil (todos os "ingredientes" só precisam ser misturados e deixados repousar sob luz natural).
O método pode ser usado com quase todos os aminoácidos presentes nos peptídeos, enquanto mantém a seletividade completa para a posição C-terminal sobre as cadeias laterais do peptídeo.
Com seu novo método, os cientistas também foram capazes de obter derivados do valioso peptídeo bioativo GRGDNP, que bloqueia a ligação das células à fibronectina, um processo importante na vasodilatação dos vasos sanguíneos, o que pode ser muito útil no estudo das doenças cardiovasculares.