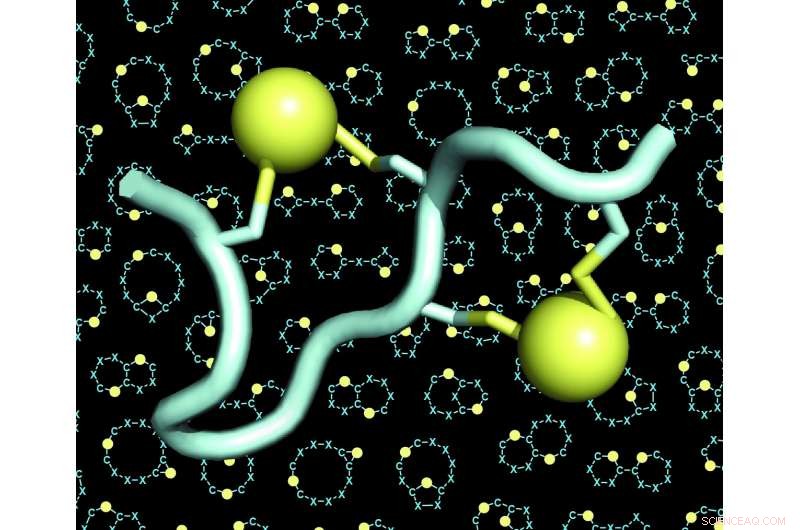
Um modelo de um peptídeo de ponte dupla (o peptídeo em azul claro, as duas pontes em amarelo). O fundo das figuras mostra muitos exemplos de esqueletos (também chamados de 'andaimes' ou 'espinhas dorsais') de peptídeos de ponte dupla. Crédito:C. Heinis / EPFL
Os peptídeos são cadeias curtas de aminoácidos que podem se ligar a proteínas e alterar sua função. Eles mostram alta afinidade de ligação, baixa toxicidade, e são fáceis de sintetizar, tudo o que torna os peptídeos ideais para uso no desenvolvimento de drogas, e muitos peptídeos de ocorrência natural, como a insulina, oxitocina, somatostatina e os antibióticos vancomicina ou polimixina B, são amplamente utilizados.
Contudo, o uso de peptídeos como drogas enfrenta dois desafios. Primeiro, afinidade de ligação:uma boa ligação requer arquiteturas de peptídeos difíceis e sequências de aminoácidos que são perfeitamente complementares em forma e carga à superfície de suas proteínas-alvo. Segundo, estabilidade do peptídeo:os peptídeos podem ser potencialmente cortados por enzimas (proteases) em menores, fragmentos inúteis ou mesmo aminoácidos únicos.
O laboratório de Christian Heinis na EPFL agora abordou esses dois desafios, desenvolvendo o novo formato de peptídeo que eles chamam de "peptídeos de ponte dupla". Estas são cadeias de 10 a 15 aminoácidos, quatro dos quais são quimicamente conectados por duas pontes. Cada ponte liga um par de dois aminoácidos cisteína - quatro no total.
Como as quatro cisteínas podem ser colocadas em muitas configurações diferentes ao longo da sequência de aminoácidos, a estratégia de dupla ponte permitiu aos pesquisadores gerar um número enormemente grande de arquiteturas de peptídeos estruturalmente diversas. Eles expandiram a diversidade ainda mais usando diferentes reagentes químicos que aumentaram o número de pontes. Os cientistas também descobriram que as quatro cisteínas podem ser ligadas por dois ligantes de três maneiras diferentes, dando origem a três arquiteturas diferentes de cada sequência de peptídeo único.
Usando essa estratégia, os pesquisadores produziram uma enorme diversidade de estruturas de peptídeos, todos com diferentes estruturas de "esqueleto". Além disso, os químicos alteraram sistematicamente os aminoácidos entre as cisteínas e geraram bibliotecas de bilhões de diferentes peptídeos de ponte dupla. Depois de examinar as bibliotecas, os pesquisadores foram capazes de isolar ligantes de alta afinidade para alvos proteicos importantes. Um desses alvos era a calicreína, uma proteína plasmática que está associada ao angioedema hereditário, um distúrbio raro de edema. Outra foi a interleucina-17, uma proteína citocina implicada em vários distúrbios inflamatórios, como artrite reumatóide e psoríase. Usando a abordagem de ponte dupla para esses dois alvos de proteína, os cientistas desenvolveram peptídeos que poderiam ligá-los com eficiência em concentrações nanomolares. No caso da calicreína, os peptídeos poderiam ligá-lo por mais de uma hora antes de se dissociar.
A estabilidade também era uma característica altamente atrativa do novo formato de peptídeo. Os peptídeos de ponte dupla dificilmente são degradados por proteases no sangue, o que é uma grande vantagem porque evita que os peptídeos sejam eliminados muito rapidamente, estendendo assim seus efeitos terapêuticos. Com base nos resultados, O laboratório de Heinis agora está aplicando o formato de peptídeo a muitos outros alvos de doenças. Eles já desenvolveram novos, até mesmo maiores bibliotecas de peptídeos de ponte dupla e os rastreou contra uma variedade de alvos relevantes para doenças. Um desses peptídeos já está em avaliação pré-clínica.