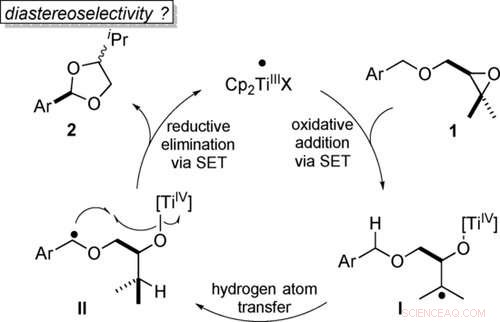
 p Transformação econômica atômica de éteres benzílicos em acetais por catálise de titanoceno (III) em etapas de elétron único (SET). Angewandte Chemie, DOI:10.1002 / anie.202013561
p Transformação econômica atômica de éteres benzílicos em acetais por catálise de titanoceno (III) em etapas de elétron único (SET). Angewandte Chemie, DOI:10.1002 / anie.202013561
p Os acetais são compostos químicos importantes que são usados, por exemplo, na produção de certos agentes médicos. Um novo método agora torna sua síntese mais fácil e ecologicamente correta. Químicos da Universidade de Bonn desenvolveram e otimizaram o processo catalítico sustentável. Simulações de computador de última geração também foram usadas. A reação é baseada em um mecanismo que freqüentemente ocorre na natureza, mas raramente foi usado em síntese química até agora. Os resultados são publicados na revista
Angewandte Chemie . p A etapa chave na produção de acetais é a ligação de dois átomos de oxigênio a um átomo de carbono. Os químicos geralmente conseguem esse arranjo com a oxidação. Agentes oxidantes fortes são normalmente usados para fazer isso, liberando um átomo de oxigênio durante a reação. O resto do agente oxidante deve ser eliminado após a síntese.
p "Em nosso estudo, Contudo, descrevemos um caminho conhecido como econômico-atômico, o que significa que não gera resíduos, "explica o Prof. Dr. Andreas Gansäuer do Instituto Kekulé de Química Orgânica e Bioquímica da Universidade de Bonn." A própria molécula inicial já contém o átomo de oxigênio necessário para a oxidação. A catálise que desenvolvemos simplesmente desloca esse oxigênio na molécula, que cria o acetal. "
p A molécula de partida contém um chamado grupo epóxi, uma espécie de "triângulo" em que dois cantos são formados por átomos de carbono e o terceiro por um átomo de oxigênio. Esses anéis triplos estão sob grande tensão e, portanto, se rompem facilmente no átomo de oxigênio. Os epóxis armazenam a energia de reação necessária como uma mola comprimida.
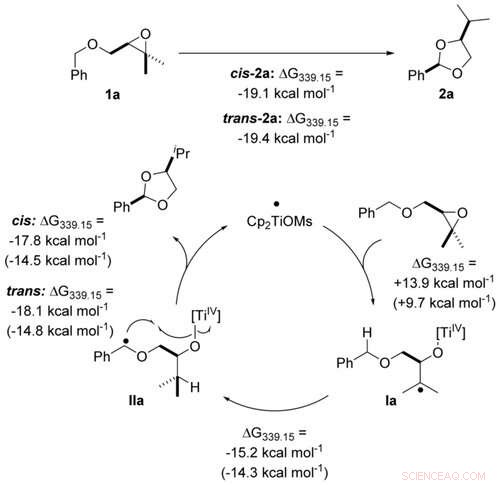 p Transformação econômica atômica de éteres benzílicos em acetais por catálise de titanoceno (III) em etapas de elétron único calculado no nível PW6B95-D4 / def2-QZVP + COSMO-RS (THF) // PBEh-3c / DCOSMO-RS (THF). Os valores entre parênteses são calculados para o catalisador Cp2TiCl. Angewandte Chemie, DOI:10.1002 / anie.202013561
p Transformação econômica atômica de éteres benzílicos em acetais por catálise de titanoceno (III) em etapas de elétron único calculado no nível PW6B95-D4 / def2-QZVP + COSMO-RS (THF) // PBEh-3c / DCOSMO-RS (THF). Os valores entre parênteses são calculados para o catalisador Cp2TiCl. Angewandte Chemie, DOI:10.1002 / anie.202013561
p
Catálise baseada no modelo da natureza
p Para atingir este objetivo, é necessário um catalisador adequado. Falando figurativamente, os átomos de oxigênio têm dois "braços" com os quais podem formar ligações. Se o anel de epóxi quebrar, um desses braços fica livre. O catalisador agora se liga a ele temporariamente. Isso inicia uma sequência de rearranjos internos da molécula (intramoleculares). No final desta sequência, o átomo de oxigênio libera o catalisador novamente e, em vez disso, se liga ao carbono desejado. "Esta etapa é chamada de recuperação de oxigênio, "diz Gansäuer.
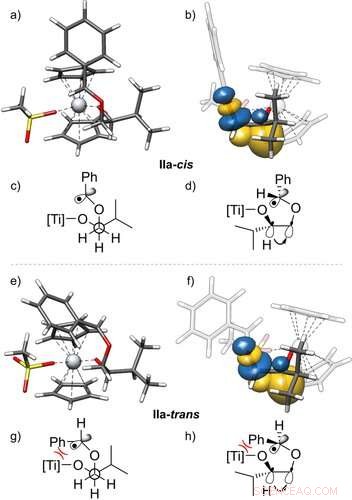 p Estruturas 3D dos radicais IIa-cis (a, b) e IIa ‐ trans (e, f) e sua estabilização por interações gauche, com vista lateral. Os orbitais de ligação natural (NBO) 23 mostrados são obtidos a partir de um cálculo PBEh-3c + CPCM (THF). Além das projeções de Newman (c, g) e estruturas em cunha e traço (d, h) desses radicais são dados. Eles mostram o orbital da ligação C − H doando para o orbital σ * ‐ da ligação C − O, visualizando o efeito gauche. Apenas uma das duas interações gauche eficazes é mostrada. Valor de isosuperfície =0,05 e − 1/2 bohr − 3/2. Angewandte Chemie, DOI:10.1002 / anie.202013561
p Estruturas 3D dos radicais IIa-cis (a, b) e IIa ‐ trans (e, f) e sua estabilização por interações gauche, com vista lateral. Os orbitais de ligação natural (NBO) 23 mostrados são obtidos a partir de um cálculo PBEh-3c + CPCM (THF). Além das projeções de Newman (c, g) e estruturas em cunha e traço (d, h) desses radicais são dados. Eles mostram o orbital da ligação C − H doando para o orbital σ * ‐ da ligação C − O, visualizando o efeito gauche. Apenas uma das duas interações gauche eficazes é mostrada. Valor de isosuperfície =0,05 e − 1/2 bohr − 3/2. Angewandte Chemie, DOI:10.1002 / anie.202013561
p Este mecanismo raramente foi usado em sínteses químicas até agora - muito diferente da natureza:o fígado, por exemplo, usa o "rebote do oxigênio" para quebrar as toxinas. Isso também requer catalisadores, as chamadas enzimas P450. Seu centro ativo contém um átomo de ferro. "O coração do nosso catalisador também consiste em um metal comum e não tóxico, ou seja, titânio, "explica o Prof. Dr. Stefan Grimme do Instituto de Química Física e Teórica da Universidade de Bonn.
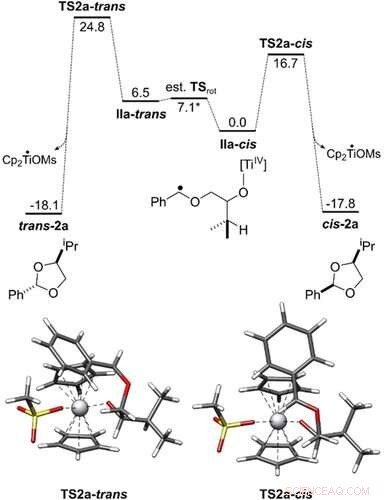 p Perfil de energia da conversão de IIa ‐ cis e IIa ‐ trans em cis ‐ 2 a e trans ‐ 2 a. Todas as energias livres de Gibbs são mostradas em kcal mol − 1. As geometrias do estado de transição foram obtidas com PBEh-3c / COSMO (THF). O ciclo catalítico foi investigado no nível de teoria PW6B95 ‐ D4 / def2 ‐ QZVP + COSMO ‐ RS (THF) // PBEh ‐ 3c / COSMO (THF). Angewandte Chemie, DOI:10.1002 / anie.202013561
p Perfil de energia da conversão de IIa ‐ cis e IIa ‐ trans em cis ‐ 2 a e trans ‐ 2 a. Todas as energias livres de Gibbs são mostradas em kcal mol − 1. As geometrias do estado de transição foram obtidas com PBEh-3c / COSMO (THF). O ciclo catalítico foi investigado no nível de teoria PW6B95 ‐ D4 / def2 ‐ QZVP + COSMO ‐ RS (THF) // PBEh ‐ 3c / COSMO (THF). Angewandte Chemie, DOI:10.1002 / anie.202013561
p
Ajuste do catalisador no computador
p Durante a síntese de acetal, o titânio primeiro absorve um átomo de oxigênio e depois o libera novamente (a oxidação é seguida por uma chamada redução). Isso só funciona eficazmente se ligar o oxigênio com força suficiente a si mesmo, sem "grudar" demais. A fim de ajustar sua afinidade de oxigênio de forma adequada, o titânio está ligado a certas moléculas, seus ligantes. Dependendo do parceiro vinculante, o metal tem então um efeito oxidante um pouco mais forte ou pode ser reduzido mais facilmente. As "moléculas sintonizadoras" mais adequadas são hoje selecionadas com o auxílio de um computador. O grupo de pesquisa em torno do Prof. Grimme se especializou nesta tarefa:Nos últimos anos, desenvolveu algoritmos que permitem simulações muito rápidas das propriedades do catalisador.
p Isso permitiu que os pesquisadores em seu estudo otimizassem seu catalisador para que convertesse completamente o material de partida no acetal desejado. "O resultado documenta muito bem como a cooperação estreita entre experimento e teoria é útil para o desenvolvimento de métodos de catálise sustentáveis, "diz Gansäuer.



