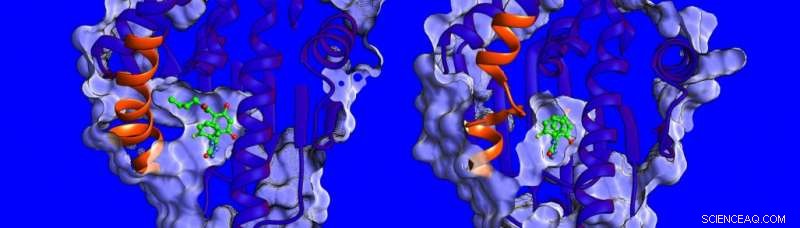
Diferenças na estrutura e dinâmica da região helicoidal (mostrada em laranja) da proteína HSP90. Crédito:Instituto Heidelberg de Estudos Teóricos
Um estudo conjunto da indústria / academia de uma proteína alvo do câncer revela uma relação incomum entre a flexibilidade do local de ligação e o tempo de vida do fármaco. Os resultados, publicado em Nature Communications , sugerem uma nova estratégia para a descoberta de medicamentos. A pesquisa foi realizada no âmbito do consórcio K4DD Kinetics for Drug Discovery, apoiado pela Innovative Medicines Initiative.
A maioria dos medicamentos exerce seu efeito terapêutico ligando-se a uma molécula de proteína alvo, interferindo assim com a função normal da proteína. Tradicionalmente, considerou-se que quanto mais fortemente uma droga se liga à sua proteína alvo, isto é, quanto maior for sua afinidade de ligação, mais eficaz será. Contudo, as drogas devem funcionar no ambiente em constante mudança dos organismos vivos. É, portanto, cada vez mais reconhecido que não apenas a afinidade de ligação e a termodinâmica, mas também os tempos de residência e a cinética do fármaco devem ser otimizados durante o processo de descoberta do fármaco.
Cinética posta à prova:estudando um alvo de câncer
Uma equipe multidisciplinar de cientistas de parceiros K4DD Merck KGaA (Darmstadt), Instituto Heidelberg de Estudos Teóricos (HITS), e o Instituto de Biologia Experimental e Tecnológica (iBET) (Lisboa), aplicou abordagens experimentais e computacionais de última geração para investigar os determinantes dos tempos de residência alvo para um conjunto de inibidores de um alvo de câncer amplamente estudado, proteína de choque térmico 90 (HSP90). Os inibidores de HSP90 podem interromper o ciclo celular e potencialmente interromper o crescimento do tumor. A equipe publicou recentemente alguns de seus resultados em Nature Communications .
Resultados surpreendentes:maior mobilidade do local de ligação leva a tempos de residência mais longos
"No momento, pouco se sabe sobre os fatores que influenciam os tempos de residência do fármaco, então decidimos medir a termodinâmica e a cinética de ligação, resolver as estruturas dos complexos de inibidor de HSP90 e simular sua dinâmica, "diz a Dra. Marta Amaral, um dos autores correspondentes. As estruturas determinadas por cristalografia de raios-X mostram que a bolsa de ligação de HSP90 é revestida por uma região que pode assumir a forma de uma hélice ou uma alça quando ligada a diferentes inibidores (ver imagem abaixo).
Os pesquisadores descobriram que os compostos que se ligam a uma hélice presente se ligam por mais tempo. "Ficamos realmente surpresos, "diz a Prof. Rebecca Wade (HITS), "quando descobrimos que um contribuinte importante para os longos tempos de residência foi a maior mobilidade da região helicoidal da bolsa de ligação quando o inibidor ligou." Este mecanismo de ligação incomum abre um novo caminho para o design de drogas:os cientistas podem considerar alvos proteicos menos rígidos e identificar moléculas que estabilizam formas mais móveis da proteína após a ligação - algo como uma bota de esqui com um forro interno adaptável que se ajusta continuamente ao pé. Os resultados deste estudo sugerem uma nova maneira de encontrar candidatos a drogas mais eficazes com propriedades cinéticas e termodinâmicas ideais.