
Um novo estudo da Universidade de Princeton e da Universidade Sapienza de Roma fornece fortes evidências para uma teoria controversa de que em temperaturas muito frias a água pode existir em duas formas líquidas distintas, sendo um menos denso e mais estruturado do que o outro. Crédito:Foto de John Salatas, Licença Creative Commons
Água, tão comum e tão essencial para a vida, age de maneiras que são bastante intrigantes para os cientistas. Por exemplo, por que o gelo é menos denso que a água, flutuando em vez de afundar como outros líquidos fazem quando congelam?
Agora, um novo estudo fornece fortes evidências para uma teoria controversa de que em temperaturas muito frias a água pode existir em duas formas líquidas distintas, sendo um menos denso e mais estruturado do que o outro.
Pesquisadores da Universidade de Princeton e da Universidade Sapienza de Roma realizaram simulações de computador de moléculas de água para descobrir o ponto crítico em que uma fase líquida se transforma na outra. O estudo foi publicado esta semana na revista. Ciência .
"A presença do ponto crítico fornece uma explicação muito simples para as esquisitices da água, "disse o Reitor de Pesquisa de Princeton, Pablo Debenedetti, a classe de 1950 Professor em Engenharia e Ciências Aplicadas, e professor de engenharia química e biológica. "A descoberta do ponto crítico é equivalente a encontrar um bem, explicação simples para as muitas coisas que tornam a água estranha, especialmente em baixas temperaturas. "
As esquisitices da água incluem que, à medida que a água esfria, ele se expande ao invés de contrair, razão pela qual a água congelada é menos densa do que a água líquida. A água também se torna mais compressível - ou compressível - em temperaturas mais baixas. Existem também pelo menos 17 maneiras pelas quais suas moléculas podem se organizar quando congeladas.
Um ponto crítico é um valor único de temperatura e pressão em que duas fases da matéria se tornam indistinguíveis, e ocorre um pouco antes de a matéria se transformar de uma fase para a outra.
As esquisitices da água são facilmente explicadas pela presença de um ponto crítico, Debenedetti disse. A presença de um ponto crítico é sentida nas propriedades da substância bem distantes do próprio ponto crítico. No ponto crítico, a compressibilidade e outras medidas termodinâmicas de como as moléculas se comportam, como a capacidade de calor, são infinitos.
Usando dois métodos computacionais diferentes e dois modelos de computador altamente realistas de água, a equipe identificou o ponto crítico líquido-líquido como estando em uma faixa de cerca de 190 a 170 graus Kelvin (cerca de -117 graus a -153 graus Fahrenheit) em cerca de 2, 000 vezes a pressão atmosférica ao nível do mar.
A detecção do ponto crítico é uma etapa satisfatória para os pesquisadores envolvidos na busca de décadas para determinar a explicação física subjacente às propriedades incomuns da água. Várias décadas atrás, os físicos teorizaram que o resfriamento da água a temperaturas abaixo de seu ponto de congelamento enquanto a mantém como um líquido - um estado "super-resfriado" que ocorre em nuvens de grande altitude - exporia as duas formas líquidas exclusivas da água a pressões suficientemente altas.
Para testar a teoria, pesquisadores se voltaram para simulações de computador. Os experimentos com moléculas de água da vida real não forneceram até agora evidências inequívocas de um ponto crítico, em parte devido à tendência de a água super-resfriada congelar rapidamente em gelo.
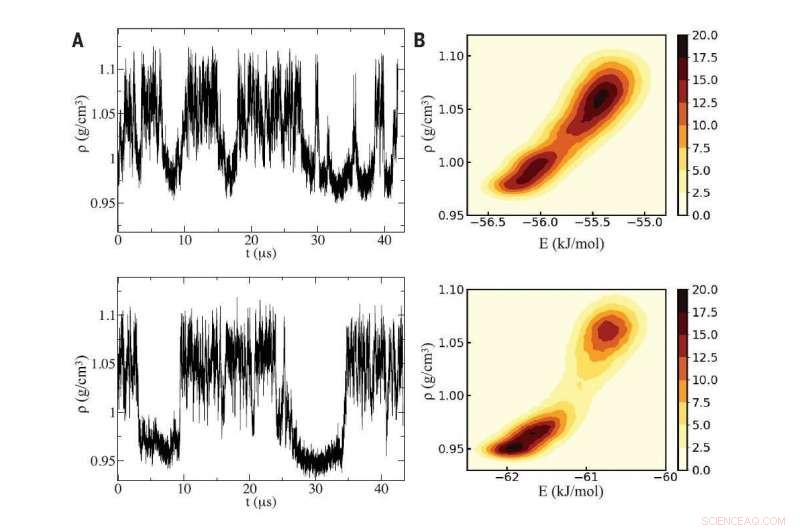
Fig A (esquerda):Usando duas simulações de computador distintas de água (painéis superior e inferior), os pesquisadores detectaram oscilações na densidade característica da água super-resfriada oscilando entre duas fases líquidas que diferem em densidade. Fig B (direita):As simulações revelaram um ponto crítico entre as duas fases líquidas, cujas diferentes densidades se originam microscopicamente na intrusão de uma molécula extra de água no ambiente local de uma molécula central genérica no líquido de alta densidade. Crédito:Reimpresso com permissão de PG Debenedetti et al, Ciência Vol 369 Edição 6501, DOI:10.1126 / science.abb9796
Francesco Sciortino, um professor de física na Universidade Sapienza de Roma, conduziu um dos primeiros estudos de modelagem enquanto era pesquisador de pós-doutorado em 1992. Esse estudo, publicado no jornal Natureza , foi o primeiro a sugerir a existência de um ponto crítico entre as duas formas líquidas.
A nova descoberta é extremamente satisfatória para Sciortino, que também é co-autor do novo estudo em Ciência . O novo estudo usou computadores de pesquisa muito mais rápidos e poderosos de hoje e modelos de água mais recentes e mais precisos. Mesmo com os poderosos computadores de pesquisa de hoje, as simulações levaram cerca de 1,5 anos de tempo de computação.
"Você pode imaginar a alegria quando começamos a ver as flutuações críticas se comportando exatamente da maneira que deveriam, "Disse Sciortino." Agora posso dormir bem, porque depois de 25 anos, minha ideia original foi confirmada. "
No caso das duas formas líquidas de água, as duas fases coexistem em equilíbrio incômodo em temperaturas abaixo de zero e em pressões suficientemente altas. Conforme a temperatura cai, as duas fases líquidas se engajam em um cabo de guerra até que uma vença e todo o líquido se torne de baixa densidade.
Nas simulações realizadas pelo pesquisador de pós-doutorado Gül Zerze em Princeton e Sciortino em Roma, à medida que baixaram a temperatura bem abaixo de zero para a faixa super-resfriada, a densidade da água flutuou descontroladamente, exatamente como previsto.
Alguns dos comportamentos estranhos da água provavelmente estão por trás de suas propriedades vitais, Zerze disse. "O fluido da vida é a água, mas ainda não sabemos exatamente por que a água não pode ser substituída por outro líquido. Achamos que a razão tem a ver com o comportamento anormal da água. Outros líquidos não apresentam esses comportamentos, então isso deve estar ligado à água como o líquido da vida. "
As duas fases da água ocorrem porque a forma da molécula de água pode levar a duas formas de compactação. No líquido de baixa densidade, quatro moléculas se agrupam em torno de uma quinta molécula central em uma forma geométrica chamada tetraedro. No líquido de alta densidade, uma sexta molécula se espreme, o que tem o efeito de aumentar a densidade local.
A equipe detectou o ponto crítico em dois modelos computadorizados de água diferentes. Para cada modelo, os pesquisadores submeteram as moléculas de água a duas abordagens computacionais diferentes para procurar o ponto crítico. Ambas as abordagens resultaram na descoberta de um ponto crítico.
Peter Poole, um professor de física na St. Francis Xavier University no Canadá, e um estudante de graduação quando colaborou com Sciortino e foi coautor do artigo de 1992 na Nature, disse que o resultado foi satisfatório. “É muito reconfortante ter este novo resultado, "Ele disse." Tem sido uma longa e às vezes solitária espera desde 1992 para ver outro caso inequívoco de uma transição de fase líquido-líquido em um modelo de água realista. "
C. Austen Angell, Professor Regentes da Arizona State University, é um dos pioneiros em experimentos na década de 1970 sobre a natureza da água super-resfriada. “Sem dúvida que este é um esforço heróico na simulação da física da água com um muito interessante, e bem-vindo, conclusão, "disse Angell, que não estava envolvido no presente estudo, em um e-mail. "Como um experimentalista com acesso a medições físicas de equilíbrio (longo prazo) em água real, Sempre me senti "seguro" contra a preempção por simuladores de computador. Mas os dados apresentados no novo artigo mostram que isso não é mais verdade. "