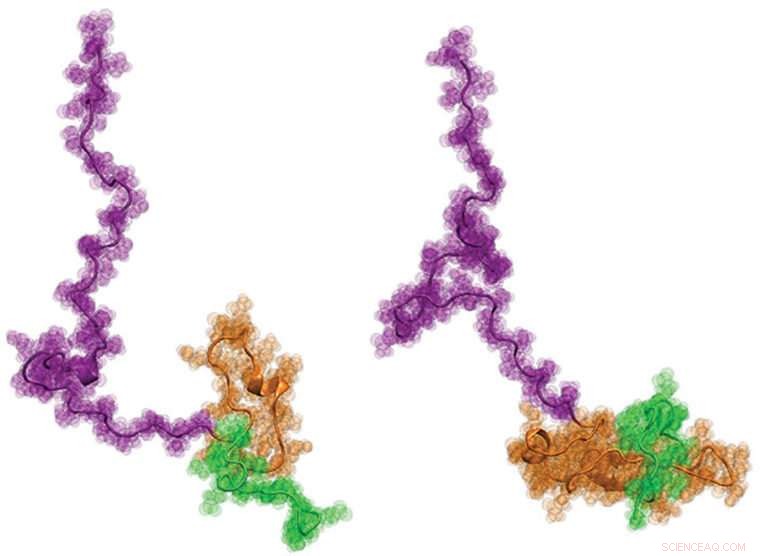
Uma coorte internacional de cientistas, incluindo engenheiros da Washington University em St. Louis, recentemente visualizou a proteína de Huntington pela primeira vez. Espera-se que saber mais sobre a estrutura - que tem um formato semelhante ao de um girino - possa ajudar a informar melhor o desenvolvimento de novas terapias para a doença. Crédito:Washington University em St. Louis
A doença de Huntington é progressiva, distúrbio neurodegenerativo fatal causado por mutações em um gene específico chamado huntingtina (Htt). Nos mais de 20 anos desde que o gene Htt foi identificado, pesquisadores se concentraram na proteína codificada pelo gene Htt, chamado Httex1. Esta proteína se acumula no cérebro de pacientes com doença de Huntington, e a hipótese predominante é que ele sofre uma mudança estrutural dramática quando um trato repetitivo do aminoácido glutamina sofre mutação em uma região anormalmente longa conhecida como trato de poliglutamina expandida mutacionalmente (polyQ).
Agora, pela primeira vez, a equipe de Hilal A. Lashuel na Ècole Polytechnique Fèdèrale de Lausanne (EPFL) na Suíça; Edward A. Lemke no Laboratório Europeu de Biologia Molecular (EMBL) na Alemanha; e Rohit V. Pappu, da Washington University em St. Louis, descobriu uma descrição estrutural detalhada de Htt como uma função do comprimento polyQ. O trabalho foi publicado recentemente no Jornal da American Chemical Society .
Um estudo em três etapas
Proteger descrições estruturais de nível atômico de Htt de comprimento total e fragmentos de proteínas relevantes para doenças referidas como Httex1 tem sido um desafio porque essas moléculas aderem umas às outras e inibem a geração de amostras de proteínas puras para estudos estruturais. “É muito difícil obter a caracterização estrutural de proteínas dentro de um cogumelo, "disse Pappu, o Edwin H. Murty Professor de Engenharia na Escola de Engenharia e Ciências Aplicadas.
"Nosso objetivo era obter insights sobre como o aumento do comprimento da repetição da cauda polyQ altera a estrutura desta proteína no nível do monômero e sob condições em que somos capazes de desvincular seu dobramento e automontagem, "disse Lashuel, professor de ciências da vida e diretor do laboratório de biologia química da neurodegeneração da EPFL.
Na primeira etapa do estudo, Lashuel e seu colega de pós-doutorado John B. Warner IV usaram novas estratégias químicas em seu laboratório para produzir amostras de Htt de alta pureza para espectroscopia molecular. Mas eles só vinham em concentrações ultrabaixas e exigiam técnicas que investigavam moléculas individuais. Warner e Lashuel possibilitaram esses experimentos gerando amostras com rótulos fluorescentes específicos do local.
Para a segunda etapa do projeto, Warner e Lashuel trabalharam com o laboratório de Lemke em EMBL para realizar a transferência de energia de ressonância de Förster (ou fluorescência) de molécula única (smFRET), que é uma técnica que pode medir distâncias entre 1-10 nanômetros dentro de moléculas individuais - neste caso, dentro de proteínas Htt individuais. Esta parte do estudo rendeu a primeira avaliação quantitativa de como as distâncias interatômicas dentro do Httex1 variam com as mutações de expansão.
Finalmente, os cientistas trabalharam com o laboratório de Pappu na Universidade de Washington, onde desenvolveu novas abordagens de modelagem de computador para produzir fisicamente precisos, modelos estruturais de nível atômico de Httex1 que melhor se adaptam a todos os dados de molécula única das duas etapas anteriores. Os resultados foram surpreendentes:a estrutura geral do Httex1 lembra a de um girino.
O efeito girino
"Arquitetonicamente, Httex1 é em forma de girino, com uma cabeça polyQ globular e uma cauda flexível, "Pappu disse." À medida que o comprimento polyQ fica mais longo, a cabeça do girino fica maior em sua área de superfície. Esta área de superfície aumentada da cabeça parece gerar interações que de outra forma não deveriam estar presentes nas células. "
A descoberta desafia as idéias de longa data sobre o acúmulo de Httex1 na doença de Huntington. "Se a hipótese prevalecente fosse verdadeira, "Pappu disse, "então o girino teria se transformado em um 'sapo' à medida que o comprimento polyQ aumentasse acima do comprimento limite, mas não parece ser o caso. Os novos resultados, em vez disso, focam nossa atenção nas novas interações celulares de ganho de função que são impulsionadas pela estrutura do girino com uma cabeça polyQ maior. "
"Embora a hipótese prevalecente tenha favorecido um modelo em que a toxicidade induzida por huntingtina mutante é impulsionada principalmente por sua propensão a dobrar incorretamente e agregar, nossos achados sugerem que as interações aberrantes no nível do monômero também podem contribuir para o início e / ou progressão da doença, "Lashuel disse.
"Esta descoberta nos permite examinar quais regiões desta proteína são importantes para atingir, e modular sua toxicidade de maneira específica, "disse Kiersten M. Ruff, um pós-doutorado no laboratório de Pappu que projetou as simulações de computador e é o co-autor do artigo.
O próximo desafio para os cientistas é entender como essas mudanças estruturais no nível do monômero de Httex1 se traduzem em agregação e toxicidade aumentadas quando o comprimento da cauda polyQ cruza o limite patogênico.
"A chave tem sido a centralidade da colaboração entre três equipes com experiência complementar e não sobreposta, todos compartilhando um compromisso com o avanço da ciência, "Lashuel disse.