Crédito:Wiley
A tuberculose é uma das doenças infecciosas com risco de vida mais difundidas. Não só a resistência aos antibióticos torna o tratamento cada vez mais difícil, mas a micomembrana relativamente impermeável da bactéria também limita a eficácia de muitos medicamentos. Em busca de novos antibióticos, pesquisadores desenvolveram um análogo estrutural do ácido micólico, o bloco de construção essencial da membrana. Conforme relatado no jornal Angewandte Chemie , esta droga bloqueia enzimas-chave usadas na biossíntese de micomembrana, aumentando significativamente a eficácia dos antibióticos convencionais.
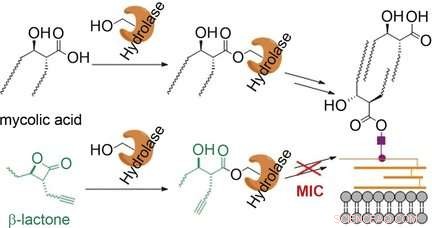
A micomembrana do patógeno da tuberculose Mycobacterium tuberculosis é uma camada dupla de lipídios que forma uma barreira externa. Os ácidos micólicos são um componente crítico. Eles são ácidos graxos β-hidroxilados ramificados com duas longas cadeias de hidrocarbonetos. A biossíntese dos ácidos micólicos e sua incorporação na micomembrana envolve uma série de etapas enzimáticas críticas nas quais as moléculas de ácido micólico são ligadas a grupos serina de várias enzimas por meio de ligações éster.
Os cientistas que trabalharam com Stephan A. Sieber e Eric J. Rubin pensaram que as moléculas camufladas como ácidos micólicos também se ligariam a essas enzimas, bloqueando-os e "infiltrando-se" no processo de biossíntese da membrana. Eles escolheram testar esta teoria usando β-lactonas, anel tensionado de quatro membros contendo uma ligação éster interna. A abertura do anel resulta em uma estrutura que corresponde à porção das moléculas de ácido micólico que se ligam às enzimas. A equipe da Universidade Técnica de Munique (Geórgia), o Harvard T.H. Escola de Saúde Pública de Chang, Harvard Medical School, e Texas A&M University testou uma ampla paleta de diferentes β-lactonas para atividade antimicobacteriana e atingiu um alvo:O composto "EZ120" inibe a biossíntese da micomembrana e mata as bactérias.
Usando testes de enzima e estudos de espectrometria de massa usando substratos marcados com 13C especiais (perfil de metabólito), os cientistas demonstraram que o novo inibidor bloqueia principalmente as enzimas Pks13 e Ag85. Pks13 é uma policetídeo sintase, que liga as duas cadeias de ácidos micólicos em uma única molécula. Ag85 é um grupo de serina hidrolases que desempenha um papel crítico na incorporação de ácidos micólicos na micomembrana.
EZ120 funciona em doses muito pequenas, é excelente na inserção de patógenos da tuberculose, e tem baixa toxicidade para células humanas. A administração em conjunto com o antibiótico vancomicina já autorizado aumenta significativamente a eficácia de ambas as substâncias individuais. Em combinação com vancomicina, EZ120 é cerca de 100 vezes mais eficaz, presumivelmente porque o enfraquecimento da micomembrana permite que ela entre mais facilmente na bactéria. Em conjunto com o fato de que vários alvos celulares são endereçados, isso poderia fornecer uma nova abordagem para o tratamento da tuberculose.