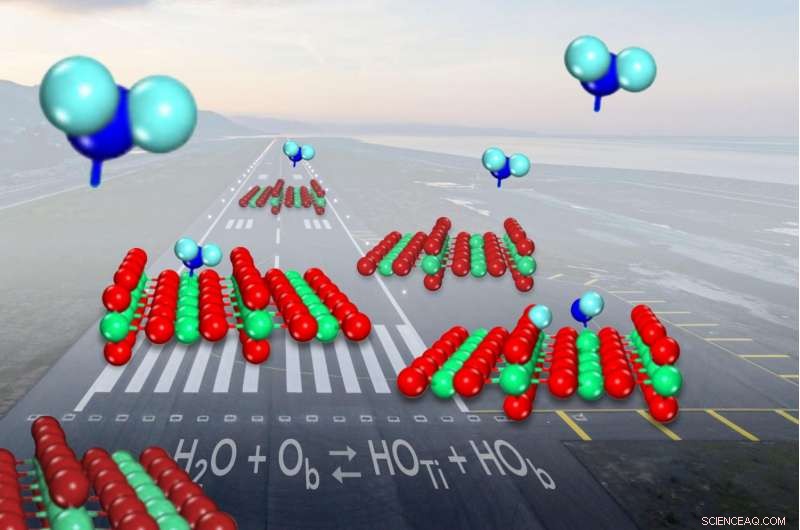
Quando a água (mostrada em azul) chega para aterrissar no catalisador comum de óxido de titânio (mostrado em vermelho e verde), ele se divide em hidroxilas (na superfície esquerda) pouco menos da metade do tempo. Crédito:Zdenek Dohnalek
Quando uma molécula de água chega para pousar no catalisador comum de óxido de titânio, ele às vezes se quebra e forma um par de fragmentos de moléculas conhecidos como hidroxilas. Mas os cientistas não conseguiram mostrar com que frequência a separação aconteceu. Agora, os pesquisadores determinaram que a água tem apenas uma probabilidade ligeiramente maior de permanecer em uma única peça ao se ligar à superfície do catalisador do que formar os pares de hidroxila.
O resultado - a vantagem da água é tão pequena - pode surpreender alguns químicos. Mas entender essa pequena vantagem tem um significado amplo para uma variedade de aplicações potenciais em indústrias que usam dióxido de titânio. Essas indústrias incluem a produção de combustível alternativo, energia solar e segurança alimentar, e até mesmo janelas com autolimpeza. Também ajudará os cientistas a entender melhor como os ácidos se comportam e a expandir seus conhecimentos sobre como as moléculas se dividem.
"Como a água se liga era a grande questão, "disse o químico Zdenek Dohnalek do Laboratório Nacional do Noroeste do Pacífico do Departamento de Energia." Os químicos misturaram informações de vários métodos diferentes, e os teóricos também tinham ideias. Usando uma combinação única de instrumentos, finalmente resolvemos. "
A equipe relatou o trabalho no Proceedings of the National Academy of Sciences .
Terra de mistério
Embora muitas indústrias usem óxido de titânio para ajudar a acelerar as reações químicas, os cientistas não descobriram todos os seus segredos. Um mistério fundamental, pesquisadores debateram por muito tempo, é a maneira pela qual a água interage com o óxido de titânio. A interação é importante por si só para dividir a água, mas também influencia o curso de muitas reações em geral.
Na superfície do óxido de titânio, as moléculas de água alternam entre estar intactas e se dividir em hidroxilas. Embora existam muitas maneiras diferentes de medir a proporção de água intacta para hidroxilas em um determinado momento, os cientistas não têm sido capazes de definir isso há décadas.
Para explorar o problema, Os pesquisadores do PNNL combinaram diferentes ferramentas de uma nova maneira. Eles enviaram feixes de água em várias velocidades para o óxido de titânio frio sob um microscópio de alta resolução conhecido como microscópio de tunelamento de varredura.
O microscópio permitiu que visualizassem os átomos de titânio e oxigênio do catalisador. Os átomos aparecem como linhas claras e escuras, como um milharal com altas fileiras de milho alternando com valas, e moléculas individuais de água aparecem como pontos brilhantes que não se alinham com as linhas.
Além de ver as moléculas de água à medida que atingem a superfície, a equipe simulou detalhes dos átomos interagindo em detalhes exatos em um computador de alto desempenho. A combinação de experimentos e simulações permitiu que a equipe resolvesse o antigo debate.
Atração instantânea
Em forma de V, uma molécula de água tem um átomo de oxigênio gordo no meio ligado a dois átomos de hidrogênio menores em cada lado. O óxido de titânio ajuda a quebrar as ligações entre os átomos para impulsionar uma reação química:os átomos de titânio prendem as moléculas de água, enquanto os oxigênios próximos, também faz parte da superfície do catalisador, afasta e captura um dos átomos de hidrogênio.
Quando isso acontece, duas hidroxilas são formadas, um de um oxigênio de superfície combinando-se com o hidrogênio e o outro remanescente da molécula de água.
Os cientistas precisavam saber com que frequência as hidroxilas se formavam. As moléculas de água permanecem praticamente intactas na superfície? Ou eles se convertem imediatamente em hidroxilas? A probabilidade de a água permanecer intacta no óxido de titânio - e a facilidade com que os hidroxilas se transformam em água - prepara o terreno para outras reações químicas.
Descobrir, os químicos tiveram que desenvolver tecnologias para medir a frequência com que as hidroxilas surgiam na superfície. Usando recursos desenvolvidos no EMSL, o Laboratório de Ciências Moleculares Ambientais, um DOE Office of Science User Facility no PNNL, eles dispararam um feixe de moléculas de água em uma superfície de óxido de titânio em baixa energia - o feixe disparou lentamente, e em alta energia - movendo-se rápido como se saísse de uma mangueira de incêndio.
Eles acabaram com pontos brilhantes na superfície, e quanto maior a energia, quanto mais manchas. Mas as manchas não pareciam brilhantes o suficiente para incluir ambas as hidroxilas, como esperado, então eles realizaram experimentos adicionais para determinar quais eram as manchas.
Spot on
A equipe injetou água na superfície de dióxido de titânio e congelou a água no local. Em seguida, eles aqueceram tudo lentamente. O aumento da temperatura revelou as manchas - que eles pensaram ser pelo menos uma hidroxila - transformando-se em moléculas de água. Isso significava que cada ponto tinha que ser, na verdade, um par de hidroxilas, porque as evidências mostraram que todas as matérias-primas necessárias para fazer uma molécula de água estavam lá, e ambas as hidroxilas eram necessárias.
Eles realizaram vários outros experimentos para determinar a temperatura na qual uma molécula de água de aterrissagem se converte em pares de hidroxila e vice-versa. Com isso, eles aprenderam que a água é apenas ligeiramente mais estável do que os pares de hidroxila na superfície - 10 por cento a mais, se formos pela quantidade de energia necessária para interrompê-los.
Simulando os pousos na água em um computador de alto desempenho, também na EMSL, os pesquisadores descobriram que as únicas moléculas de água que aderiram ao catalisador foram aquelas que caíram em uma vala figurativa dentro de um milharal, onde o oxigênio da água enfrentou um átomo de titânio na vala.
Se a água entrou com a velocidade certa, a água reorientou e atraiu um de seus hidrogênios para um oxigênio próximo, formando os pares de hidroxila vistos nos experimentos. Se não, a molécula de água simplesmente ricocheteou.
"Descobrimos que a eletrostática - a mesma estática que faz faíscas quando você esfrega os pés no tapete - ajudou a direcionar as moléculas de água para a superfície, "disse o químico teórico e co-autor Roger Rousseau.
Todos esses detalhes ajudarão os pesquisadores a entender melhor a catálise e melhorar nossa compreensão das reações químicas. Além disso, os resultados revelam um valor que os cientistas há muito tentam definir - o quão fácil ou difícil é para a água perder um hidrogênio no óxido de titânio.