A descoberta de um fator de choque térmico atípico, HSF5, envolvido em mecanismos meióticos tem implicações para a infertilidade masculina
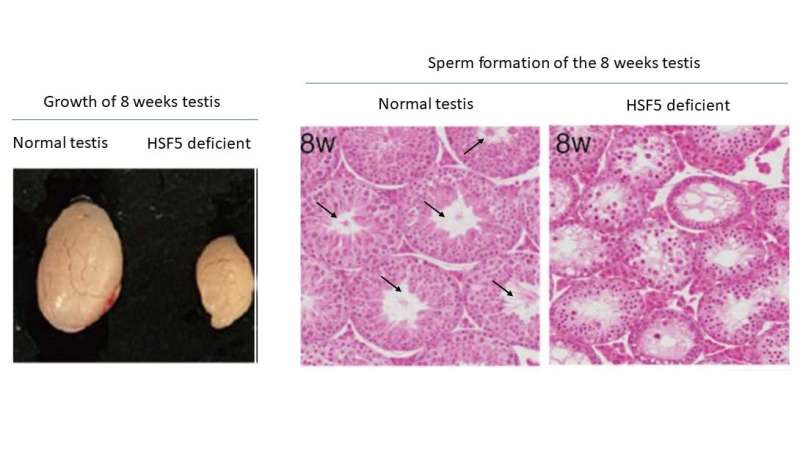 Exclusão de hsf5 em camundongos resulta no desenvolvimento prejudicado dos testículos (esquerda) e na ausência de espermátides e espermatozóides (direita), o que leva à falha na formação dos espermatozoides. Crédito:Kei-ichiro Ishiguro, Universidade Kumamoto
Exclusão de hsf5 em camundongos resulta no desenvolvimento prejudicado dos testículos (esquerda) e na ausência de espermátides e espermatozóides (direita), o que leva à falha na formação dos espermatozoides. Crédito:Kei-ichiro Ishiguro, Universidade Kumamoto Pesquisadores da Universidade de Kumamoto identificaram um novo fator de choque térmico (HSF), designado como HSF5, que desempenha um papel crucial na conclusão da meiose e na ativação de genes essenciais para a formação de espermatozoides. Esta descoberta fornece informações valiosas sobre as causas subjacentes da falha espermatogênica, o principal contribuinte para a infertilidade masculina.
Além disso, ao contrário de outros fatores típicos de choque térmico, que regulam principalmente a expressão genética em resposta ao estresse, como o choque térmico, o HSF5 desempenha um papel específico na produção de germes masculinos durante a meiose em condições sem estresse.
Na divisão celular eucariótica, a informação genômica é distribuída igualmente às células-filhas durante a mitose, ao passo que é reduzida à metade durante um tipo especializado de divisão celular chamado meiose, que é necessária para a produção de células germinativas. Nas células germinativas masculinas, a formação dos espermatozoides segue a conclusão da meiose, com múltiplos programas reguladores de genes.
No entanto, os mecanismos que regem a progressão meiótica e os factores de transcrição específicos envolvidos permanecem pouco compreendidos, colocando desafios significativos na medicina reprodutiva, particularmente no que diz respeito à infertilidade masculina.
Para colmatar estas lacunas, o Professor Kei-ichiro Ishiguro, o Professor Assistente Ryuki Shimada e a sua equipa de investigação pretendem esclarecer os mecanismos que regulam a meiose masculina que levam à produção de espermatozoides, concentrando-se na identificação e caracterização dos fatores de transcrição relacionados. O artigo foi publicado na revista Nature Communications .
Em um estudo anterior, a equipe identificou um gene interruptor de meiose, MEIOSIN, que ativa a expressão de centenas de genes envolvidos na formação de espermatozoides. Dentre esses genes, o fator de choque térmico surgiu como foco de interesse dos testículos devido à sensibilidade dos testículos ao estresse térmico, dado seu posicionamento externo, que mantém uma temperatura de 3 a 4 graus Celsius inferior à temperatura interna do corpo de 37 graus Celsius.
Embora os principais papéis dos fatores de choque térmico, como HSF1, HSF2, HSF3 e HSF4, tenham sido bem identificados, a função do HSF5 permanece obscura.
“Se o HSF5 partilha funções semelhantes com outros factores de choque térmico, ou exibe funções completamente diferentes, coloca uma questão intrigante, e abordar esta questão foi a intenção original do nosso estudo”, explica o professor Ishiguro.
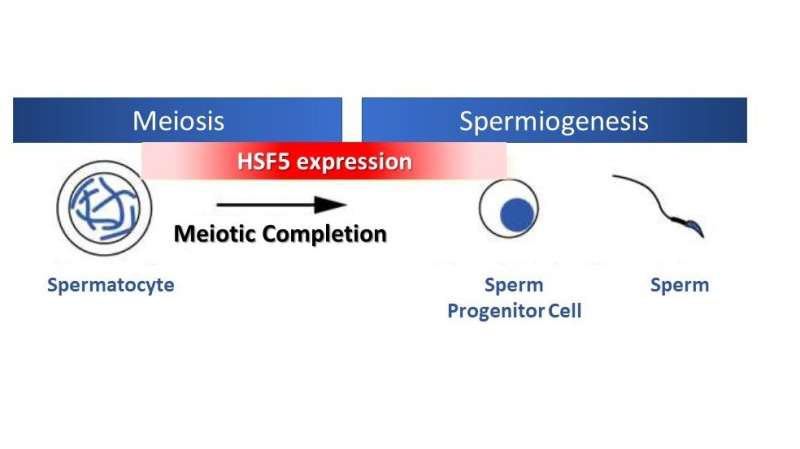 O HSF5 é necessário para que os espermatócitos progridam além do subestágio da prófase meiótica durante a espermiogênese em condições sem estresse. Crédito:Kei-ichiro Ishiguro, Universidade Kumamoto
O HSF5 é necessário para que os espermatócitos progridam além do subestágio da prófase meiótica durante a espermiogênese em condições sem estresse. Crédito:Kei-ichiro Ishiguro, Universidade Kumamoto
Surpreendentemente, diferente de outros HSFs que respondem ao estresse, o estudo mostrou que o HSF5 desempenha um papel essencial na progressão da prófase meiótica em células germinativas masculinas sob condições sem estresse. O HSF5 é necessário para a progressão além do estágio de paquíteno durante a espermatogênese, orientando o programa meiótico até a conclusão e ativando genes associados à formação de espermatozoides.
Tal como outros factores de transcrição, o HSF5 liga-se a promotores de ADN para regular a expressão genética. O que distingue o HSF5 é a sua especificidade única de alvo. A pesquisa revelou que o motivo de DNA que ele reconhece para ligação ao promotor do gene difere daqueles ligados por outros fatores canônicos de transcrição da família HSF.
Todas essas descobertas ressaltam o papel atípico do HSF5 na expressão gênica durante a prófase meiótica em homens.
Os resultados deste estudo foram validados através de experimentação em ratos, com um reconhecimento crucial de que o HSF5 também está presente em humanos. Dado que muitas causas subjacentes de infertilidade em humanos, especialmente em casos de falha espermatogênica, permanecem indefinidas, espera-se que os resultados deste estudo contribuam significativamente para a compreensão da patogênese da infertilidade masculina.

