 GoT – ChA aplicado a amostras de MF humanas com mutação JAK2V617F. Crédito:Natureza (2024). DOI:10.1038/s41586-024-07388-y
GoT – ChA aplicado a amostras de MF humanas com mutação JAK2V617F. Crédito:Natureza (2024). DOI:10.1038/s41586-024-07388-y Uma equipe co-liderada por pesquisadores da Weill Cornell Medicine e do New York Genome Center desenvolveu um método avançado para revelar como as mutações genéticas perturbam o empacotamento normal do DNA. Estas alterações estruturais, que alteram os padrões de atividade genética numa célula, são conhecidas como alterações epigenéticas e podem levar à malignidade.
O novo método, descrito em artigo publicado na Nature , oferece aos biólogos uma ferramenta poderosa que pode ser aplicada em muitos campos de investigação, desde a biologia celular básica até o estudo de como os cânceres se originam. Os pesquisadores demonstraram o novo método usando-o para esclarecer como uma mutação genética comum exerce seus efeitos em dois tipos raros de câncer no sangue.
“Esta nova técnica deve permitir amplas explorações futuras das ligações entre mutações e alterações epigenéticas no contexto de cânceres e condições relacionadas”, disse o autor sênior do estudo, Dr. Dan Landau, professor de medicina na Divisão de Hematologia e Oncologia Médica da Weill. Cornell Medicine e membro do corpo docente do New York Genome Center.
O estudo foi co-liderado pelo Dr. Franco Izzo, pesquisador de pós-doutorado no Laboratório Landau durante o estudo, agora professor assistente na Escola de Medicina Icahn no Monte Sinai.
A nova conquista é a mais recente de uma série de inovações em perfis de célula única do grupo de pesquisa de Landau. Esses métodos, também chamados de métodos "multiômicos de célula única", permitem aos pesquisadores caracterizar mutações de DNA, padrões de atividade genética, proteínas de superfície celular e outras camadas de informação - tudo em uma célula individual, usando automação para processar milhares de informações. células por vez.
Em contraste, métodos mais antigos são usados em amostras em massa, que normalmente contêm misturas de diferentes tipos de células, bem como células mutadas e não mutadas – limitando enormemente qualquer análise.
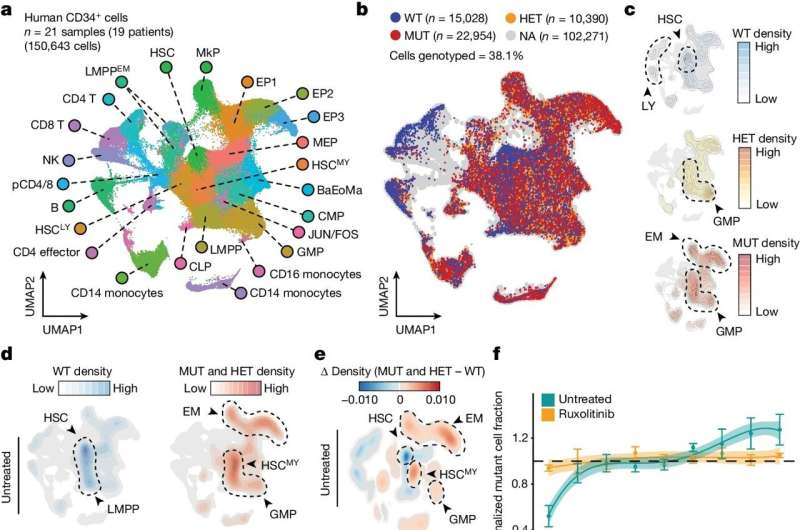
Neste caso, a equipe desenvolveu um método unicelular mais sensível e preciso para detectar mutações de interesse no DNA. Eles então combinaram isso com uma nova técnica para mapear a “acessibilidade da cromatina” de uma célula – essencialmente os locais onde o DNA é relativamente aberto e acessível para a transcrição genética – como um quadro amplo do estado epigenético da célula.
Os pesquisadores denominaram essas técnicas emparelhadas de "Genotipagem de loci direcionados com acessibilidade à cromatina unicelular" ou "GoT-ChA", e mostraram que poderiam integrar GoT-ChA com métodos unicelulares para traçar o perfil de outras camadas de informação, como RNAs e células- proteínas de superfície.
Os cientistas demonstraram o poder de seu novo kit de ferramentas usando-o para estudar células sanguíneas coletadas de pacientes com dois tipos raros de câncer no sangue, policitemia vera e mielofibrose. Estes cancros são geralmente provocados por uma mutação específica num gene chamado JAK2 – uma mutação que tem sido implicada noutras condições e também é encontrada em muitas pessoas aparentemente saudáveis.
Ambos os cancros também apresentam perturbações no processo normal de maturação das células sanguíneas, o que implica que a mutação JAK2 induz alterações epigenéticas significativas – mas as limitações dos métodos mais antigos significavam que estas alterações epigenéticas e outros efeitos a jusante da mutação não eram bem compreendidos. Com o GoT-ChA, os pesquisadores conseguiram catalogar esses efeitos detalhadamente.
“Pensava-se que na mielofibrose, por exemplo, a inflamação da medula óssea era impulsionada pelo microambiente da medula, mas descobrimos que as alterações inflamatórias nas células estaminais do sangue resultam directamente da mutação JAK2 e também dependem do tipo de célula”, disse Landau, que é também membro do Sandra and Edward Meyer Cancer Center e do Englander Institute of Precision Medicine da Weill Cornell Medicine.
Os resultados sugerem que novos medicamentos inibidores potentes de JAK2, atualmente em desenvolvimento, podem ser úteis no tratamento de pacientes com mielofibrose, disse ele.
Landau observou que o GoT-ChA deveria ser geralmente útil para estudar condições nas quais mutações no DNA – que podem surgir ao longo da vida por várias razões – estão presentes apenas em uma minoria de células de um órgão e são, portanto, difíceis ou impossíveis de estudar com métodos tradicionais. , técnicas pré-unicelulares.
Os co-autores do estudo, além de Izzo, foram M.D.-Ph.D. o estudante Robert Myers, o pós-doutorado Saravanan Ganesan e o doutorando Levan Mekerishvili, todos do Laboratório Landau.
