Um passo essencial para uma célula germinativa, um salto gigante para o futuro da medicina reprodutiva
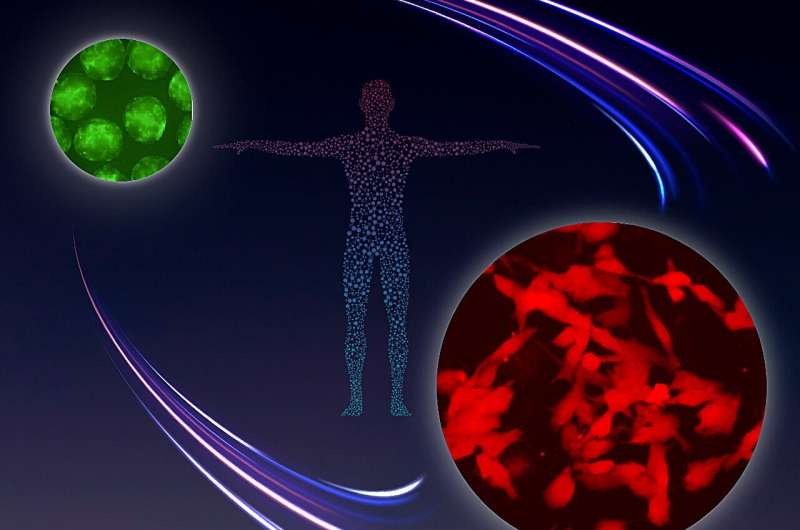 Imagem inspirada no Programa Apollo da NASA, representando a diferenciação bem-sucedida de células germinativas in vitro de células semelhantes a células germinativas primordiais humanas TFAP2C-EGFP +ve (hPGCLCs; rotuladas em verde) para DAZL-tdTomato +ve pró-espermatogônias mitóticas humanas ( marcado em vermelho). Crédito:WPI-ASHBi/Universidade de Kyoto
Imagem inspirada no Programa Apollo da NASA, representando a diferenciação bem-sucedida de células germinativas in vitro de células semelhantes a células germinativas primordiais humanas TFAP2C-EGFP +ve (hPGCLCs; rotuladas em verde) para DAZL-tdTomato +ve pró-espermatogônias mitóticas humanas ( marcado em vermelho). Crédito:WPI-ASHBi/Universidade de Kyoto Embora as tecnologias de reprodução assistida (TAR), como a fertilização in vitro (FIV), tenham tido um impacto tremendo no tratamento de certas formas de infertilidade – nem todas as formas de infertilidade podem ser combatidas com as estratégias existentes.
Recentemente, surgiu uma tecnologia poderosa – conhecida como gametogênese humana in vitro (IVG) – usando células-tronco pluripotentes (PSCs), como células-tronco pluripotentes induzidas (iPSCs) de pacientes, para gerar células germinativas humanas com a capacidade de potencialmente dar origem para amadurecer gametas na cultura, oferecendo uma porta de entrada para o tratamento de todas as formas de infertilidade – independentemente do gênero.
No entanto, a investigação da IVG humana ainda permanece numa fase inicial, sendo o objectivo actual reconstituir o processo completo da gametogénese humana. Até o momento, um grande desafio tem sido recapitular na população fundadora de células germinativas, ou nas células germinativas primordiais humanas (hPGCs), um evento marcante conhecido como reprogramação epigenética - na qual a "memória" parental herdada das células, presente em seu O DNA é redefinido/apagado – o que é necessário para a diferenciação adequada das células germinativas.
Agora, em um estudo publicado na Nature , pesquisadores do Instituto de Estudos Avançados de Biologia Humana (WPI-ASHBi) da Universidade de Kyoto, liderados pelo Dr. Mitinori Saitou, identificaram condições de cultura robustas necessárias para impulsionar a reprogramação epigenética e a diferenciação de células germinativas em precursores de gametas maduros, o mitótico pró-espermatogônias e pró-oogônias com capacidade de ampla amplificação, alcançando um novo marco para a pesquisa de IVG humano.
Trabalhos anteriores da equipe de Saitou e de outros grupos tiveram sucesso na geração das chamadas células semelhantes a células germinativas primordiais humanas (hPGCLCs) a partir de PSCs in vitro, que recapitularam várias características fundamentais do hPGC, incluindo a capacidade de propagação. No entanto, estes hPGCLCs não foram capazes de sofrer reprogramação e diferenciação epigenética.
Embora tais limitações possam ser contornadas pela agregação de hPGCLCs com células gonadais embrionárias (não germinais) de camundongo para imitar o microambiente do testículo/ovário, esse processo é altamente ineficiente (com aproximadamente apenas 1/10 das células se diferenciando). Além disso, a introdução de células não humanas não é ideal nem prática do ponto de vista da aplicação clínica. Portanto, para atingir o objetivo final da pesquisa de IVG humano, é essencial identificar as condições mínimas de cultura necessárias para gerar gametas humanos maduros.
Em seu novo estudo, Saitou e colegas conduziram uma triagem baseada em cultura celular para identificar potenciais moléculas de sinalização necessárias para impulsionar a reprogramação epigenética e a diferenciação de hPGCLCs em pró-espermatogônias e ovogônias mitóticas. Surpreendentemente, os autores descobriram que a molécula sinalizadora de desenvolvimento bem estabelecida, a proteína morfogenética óssea (BMP), desempenhou um papel crucial neste processo de reprogramação e diferenciação dos hPGCLCs.
“De fato, considerando que a sinalização BMP já tem um papel estabelecido na especificação de células germinativas, foi altamente inesperado que ela também impulsionasse a reprogramação epigenética do hPGCLC”, diz Saitou.
Estas pró-espermatogônias / oogônias mitóticas derivadas de hPGCLC não apenas exibiram semelhanças na expressão gênica e nos perfis epigenéticos com a diferenciação real de hPGC em nossos corpos, mas também sofreram extensa amplificação (mais de 10 bilhões de vezes).
“Nossa abordagem permite a amplificação quase indefinida de pró-espermatogônias e oogônias mitóticas em cultura e agora também temos a capacidade de armazenar e reexpandir essas células conforme necessário”, diz Saitou.
Os autores também revelam os mecanismos potenciais de como a sinalização de BMP pode levar à reprogramação epigenética e à diferenciação de hPGCLC.
"BMP (sinalização) parece estar atenuando a via de sinalização MAPK/ERK (proteína quinase ativada por mitógeno/quinase regulada extracelular) e as atividades de novo e de manutenção da DNMT (DNA metiltransferase), mas investigações adicionais serão necessárias para determinar o mecanismo preciso e se isso é direto ou indireto", explica Saitou.
“Nosso estudo representa não apenas um avanço fundamental em nossa compreensão da biologia humana e dos princípios por trás da reprogramação epigenética em humanos, mas também um verdadeiro marco na pesquisa de IVG em humanos”, diz Saitou.
Saitou diz:"Embora ainda restem muitos desafios e o caminho certamente será longo, especialmente quando se consideram as implicações éticas, legais e sociais associadas à aplicação clínica do IVG humano, no entanto, demos agora um salto significativo em direção à tradução potencial da IVG na medicina reprodutiva."
