A protease reaproveitada controla importante proteína ativadora de moléculas de sinalização
 Através de estruturas proteicas obtidas usando microscopia crioeletrônica, Chia-Hsueh Lee, Ph.D., Departamento de Biologia Estrutural de St. Jude demonstrou o papel da "pseudoprotease" iRhom2 na regulação do ciclo de vida de ADAM17, uma importante molécula sinalizadora ativador. Crédito:Hospital de Pesquisa Infantil St. Jude
Através de estruturas proteicas obtidas usando microscopia crioeletrônica, Chia-Hsueh Lee, Ph.D., Departamento de Biologia Estrutural de St. Jude demonstrou o papel da "pseudoprotease" iRhom2 na regulação do ciclo de vida de ADAM17, uma importante molécula sinalizadora ativador. Crédito:Hospital de Pesquisa Infantil St. Jude A comunicação eficiente entre as células é vital para muitos processos biológicos, como o recrutamento de células imunológicas para combater doenças. A rápida liberação de pelo menos 80 moléculas sinalizadoras, incluindo fator de necrose tumoral e fator de crescimento epidérmico, é controlada por uma protease ligada à membrana chamada ADAM17.
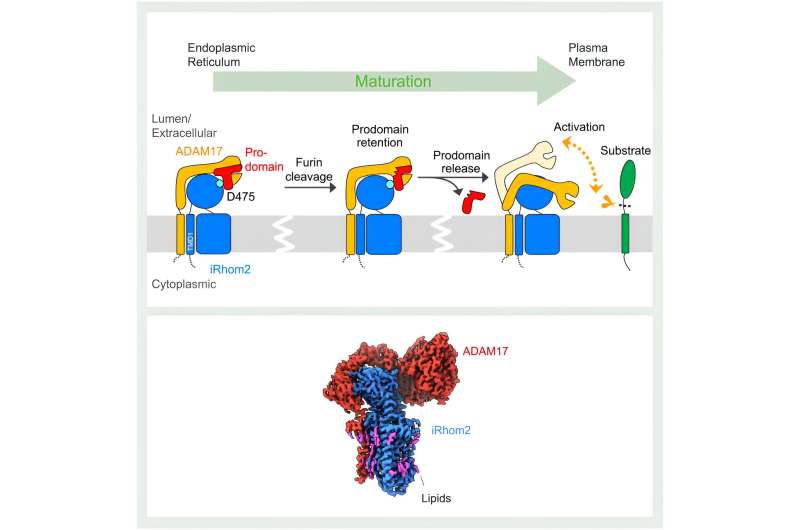
Este processo envolve a clivagem (eliminação) do ADAM17 das moléculas sinalizadoras de suas formas precursoras na membrana de uma célula. A "pseudoprotease" iRhom2 auxilia na maturação e transporte de ADAM17. A falta de conhecimento estrutural, no entanto, deixou pouco claro os mecanismos subjacentes a este processo.
Publicado hoje em Molecular Cell Jude Children's Research Hospital e da Universidade de Oxford usaram microscopia crioeletrônica para revelar uma série de estruturas do complexo humano ADAM17/iRhom2 nos estados ativo e inativo. Estas estruturas mostram que o iRhom2 atua como um guardião do ciclo de vida do ADAM17, interagindo com regiões-chave do ADAM17 que controlam a sua atividade.
O trabalho também oferece caminhos potenciais para o desenvolvimento de medicamentos para combater doenças de inflamação crônica e desregulação autoimune. "Acreditamos que há potencial para projetar pequenas moléculas que tenham como alvo o iRhom2 em vez do ADAM17 diretamente, ou a interface entre o iRhom2 e o ADAM17", disse o coautor correspondente, Chia-Hsueh Lee, Ph.D., Departamento de Biologia Estrutural de St. .
A protease extinta encontra um novo sopro de vida
iRhom2 é uma pseudoprotease:possui todas as características estruturais de uma protease da família rombóide, exceto que não possui a capacidade de definir protease para clivar proteínas. No entanto, como um cachorro velho aprendendo novos truques, o iRhom2 desempenha papéis recém-descobertos na estrutura e no transporte do ADAM17.
Como revelaram estudos estruturais, o impacto do iRhom2 na função ADAM17 começa durante a síntese inicial das duas proteínas. “O retículo endoplasmático é onde o ADAM17 e o iRhom2 são produzidos e, nesta fase, eles formam um complexo”, explicou Lee. iRhom2 facilita então o transporte de ADAM17 para o aparelho de Golgi para maturação, onde o conceito anterior de iRhom2 servindo apenas como um "andaime passivo" foi posto à prova pelas estruturas de Lee.
 Resumo gráfico. Crédito:Célula Molecular (2024). DOI:10.1016/j.molcel.2024.04.025
Resumo gráfico. Crédito:Célula Molecular (2024). DOI:10.1016/j.molcel.2024.04.025
Presume-se que a interação entre iRhom2 e ADAM17 ocorra exclusivamente entre os domínios transmembranares das proteínas, que fixam as proteínas à membrana celular. Para surpresa dos investigadores, as duas proteínas também interagem através das suas regiões extracelulares. Através dessas interações, o iRhom2 mantém uma região importante do ADAM17 chamada prodomínio. O prodomínio é uma região que atua como alfinete de segurança em um extintor de incêndio.
“O próprio ADAM17 é autoinibido. Ele tem um limite de prodomínio para bloquear seu próprio sítio de protease”, explicou Lee.
iRhom2 ajuda a limitar a atividade do ADAM17
Dentro do aparelho de Golgi, esse limite de pró-domínio autorregulado é clivado. No entanto, o iRhom2 retém a capa ADAM17 até que o complexo atinja a membrana celular. Esta etapa é crucial para evitar a ativação prematura do ADAM17. As novas estruturas revelam que uma vez removida a tampa, o ADAM17 é ativado. Esta ativação é marcada por um ganho significativo de flexibilidade, o que permite ao ADAM17 procurar substratos no espaço circundante.
Foi demonstrado que ADAM17 desempenha um papel no desenvolvimento e progressão de vários tipos de câncer; no entanto, a família de proteínas ADAM está bem conservada. Uma droga que tem como alvo o ADAM17 pode levar a efeitos fora do alvo. Lee está otimista de que as estruturas podem oferecer um modelo para a engenhosidade no design de medicamentos.
"Com base em nosso modelo, se pudéssemos manter essas duas proteínas juntas, por exemplo, através de um ligante que aumenta a interação entre iRhom2 e ADAM17, então o iRhom2 não liberará o limite do prodomínio", disse Lee. "Isso reduzirá significativamente a atividade do ADAM17."
Os primeiros autores do estudo são Fangfang Lu, Universidade de Oxford e Hongtu Zhao, St. Jude. Os outros co-autores correspondentes do estudo são Hongtu Zhao, St. Jude e Matthew Freeman, da Universidade de Oxford. Os autores adicionais do estudo são Yaxin Dai e Yingdi Wang, St. Jude.

