A bactéria Neisseria gonorrhoeae pode ter impulsionado a evolução de variantes de genes humanos que protegem contra a demência. Crédito:Instituto Nacional de Alergia e Doenças Infecciosas, Institutos Nacionais de Saúde
Pesquisadores da Escola de Medicina da Universidade da Califórnia em San Diego descobriram anteriormente um conjunto de mutações genéticas humanas que protegem os adultos mais velhos contra o declínio cognitivo e a demência. Em um novo estudo, publicado em 9 de julho de 2022 em
Molecular Biology and Evolution , eles se concentram em um desses genes mutantes e tentam rastrear sua evolução – quando e por que ele apareceu no genoma humano. As descobertas sugerem que a pressão seletiva de patógenos infecciosos como a gonorreia pode ter promovido o surgimento dessa variante genética no Homo sapiens e, inadvertidamente, apoiado a existência de avós na sociedade humana.
A biologia da maioria das espécies animais é otimizada para reprodução, muitas vezes à custa de saúde futura e expectativa de vida mais longa. Na verdade, os humanos são uma das únicas espécies conhecidas que vivem bem após a menopausa. De acordo com a "hipótese da avó", isso ocorre porque as mulheres mais velhas fornecem um apoio importante na criação de bebês e crianças humanas, que exigem mais cuidados do que os filhotes de outras espécies. Os cientistas agora estão tentando entender quais características da biologia humana tornam possível essa saúde a longo prazo.
Quando os pesquisadores compararam os genomas humanos e de chimpanzés, eles descobriram que os humanos têm uma versão única do gene para CD33, um receptor expresso em células imunes. O receptor CD33 padrão se liga a um tipo de açúcar chamado ácido siálico com o qual todas as células humanas são revestidas. Quando a célula imune detecta o ácido siálico via CD33, ela reconhece a outra célula como parte do corpo e não a ataca, impedindo uma resposta autoimune.
O receptor CD33 também é expresso em células imunes do cérebro chamadas microglia, onde ajuda a controlar a neuroinflamação. No entanto, a microglia também tem um papel importante na remoção de células cerebrais danificadas e placas amilóides associadas à doença de Alzheimer. Ao se ligarem aos ácidos siálicos dessas células e placas, os receptores CD33 regulares na verdade suprimem essa importante função microglial e aumentam o risco de demência.
É aí que entra a nova variante do gene. Em algum lugar ao longo da linha evolutiva, os humanos pegaram uma forma mutante adicional de CD33 que não possui o local de ligação ao açúcar. O receptor mutado não reage mais aos ácidos siálicos nas células e placas danificadas, permitindo que a micróglia as quebre. De fato, níveis mais altos dessa variante de CD33 foram independentemente considerados protetores contra a doença de Alzheimer de início tardio.
Ao tentar entender quando essa variante genética surgiu pela primeira vez, o coautor sênior Ajit Varki, MD, Distinguished Professor of Medicine and Cellular and Molecular Medicine da UC San Diego School of Medicine, e colegas encontraram evidências de forte seleção positiva, sugerindo que algo estava impulsionando que o gene evolua mais rapidamente do que o esperado. Eles também descobriram que essa versão específica do CD33 não estava presente nos genomas de neandertais ou denisovanos, nossos parentes evolutivos mais próximos.
“Para a maioria dos genes que são diferentes em humanos e chimpanzés, os neandertais geralmente têm a mesma versão que os humanos, então isso foi realmente surpreendente para nós”, disse Varki. “Essas descobertas sugerem que a sabedoria e o cuidado de avós saudáveis podem ter sido uma importante vantagem evolutiva que tivemos sobre outras espécies antigas de hominídeos”.
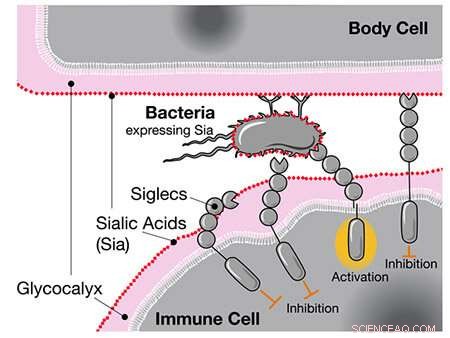
Quando Siglecs como o CD33 detectam ácidos siálicos humanos, eles inibem a resposta da célula imune, mesmo que esses ácidos estejam localizados em bactérias. Crédito:UC San Diego Health Sciences
Varki liderou o estudo com Pascal Gagneux, Ph.D., professor de patologia da UC San Diego School of Medicine e professor do Departamento de Antropologia. Os autores disseram que o estudo fornece novas evidências que apoiam a hipótese da avó.
Ainda assim, a teoria evolutiva diz que o sucesso reprodutivo é o principal impulsionador da seleção genética, não a saúde cognitiva pós-reprodutiva. Então, o que estava impulsionando a prevalência dessa forma mutante de CD33 em humanos?
Uma possibilidade, sugerem os autores, é que doenças altamente infecciosas como a gonorreia, que podem ser prejudiciais à saúde reprodutiva, possam ter impactado a evolução humana. As bactérias da gonorreia se revestem dos mesmos açúcares aos quais os receptores CD33 se ligam. Como um lobo em pele de cordeiro, as bactérias são capazes de enganar as células imunológicas humanas para não identificá-las como invasores externos.
Os pesquisadores sugerem que a versão mutante do CD33 sem um sítio de ligação ao açúcar surgiu como uma adaptação humana contra tal "mimetismo molecular" pela gonorreia e outros patógenos. De fato, eles confirmaram que uma das mutações específicas de humanos foi capaz de abolir completamente a interação entre a bactéria e o CD33, o que permitiria que as células imunes atacassem as bactérias novamente.
Ao todo, os autores acreditam que os humanos inicialmente herdaram a forma mutante do CD33 para proteger contra a gonorreia durante a idade reprodutiva, e essa variante do gene foi posteriormente cooptada pelo cérebro por seus benefícios contra a demência.
"É possível que o CD33 seja um dos muitos genes selecionados por suas vantagens de sobrevivência contra patógenos infecciosos no início da vida, mas que são secundariamente selecionados por seus efeitos protetores contra demência e outras doenças relacionadas ao envelhecimento", disse Gagneux.
Os co-autores incluem Sudeshna Saha, Naazneen Khan, Andrea Verhagen, Aniruddha Sasmal e Sandra Diaz na UC San Diego; Troy Comi e Joshua M. Akey na Universidade de Princeton; Hai Yu e Xi Chen na UC Davis e Martin Frank na Biognos AB.

