Novo estudo revela mecanismo de como os príons transmissores de doenças podem pular de uma espécie para outra
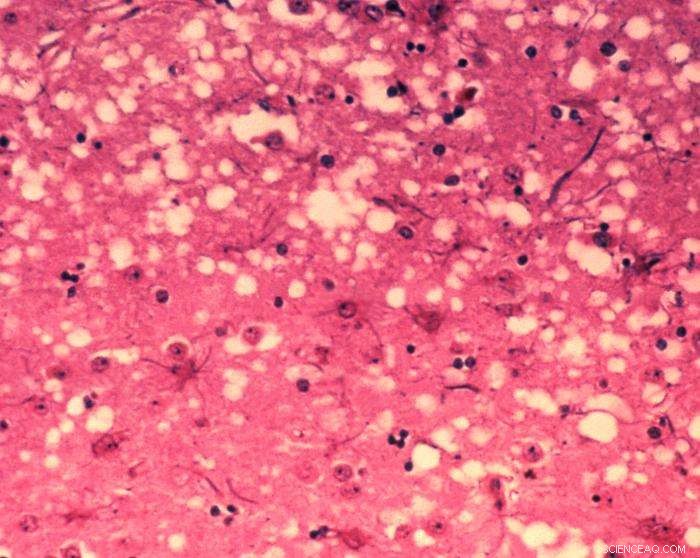
Esta micrografia de tecido cerebral revela as alterações histopatológicas citoarquitetônicas encontradas na encefalopatia espongiforme bovina. A presença de vacúolos, ou seja, “buracos” microscópicos na substância cinzenta, dá ao cérebro das vacas afetadas pela BSE uma aparência esponjosa quando seções de tecido são examinadas em laboratório. Crédito:Dr. Al Jenny - Biblioteca de imagens de saúde pública, APHIS:domínio público
Em um novo estudo, pesquisadores da Case Western Reserve University School of Medicine identificaram a estrutura das fibrilas de proteínas ligadas a uma forma hereditária de doença priônica humana. Essa percepção, dizem eles, revela o mecanismo de como os príons podem pular entre algumas espécies animais, mantendo uma barreira de transmissibilidade entre outras espécies.
Embora suas descobertas não tenham implicações imediatas para o desenvolvimento de novas terapias para distúrbios de príons humanos mais comuns, como a doença de Creutzfeldt-Jakob, o trabalho sugere que o potencial de transmissão da doença de uma espécie para outra pode ser previsto com base em informações estruturais.
"Uma das principais questões restantes no campo das doenças priônicas é por que essas doenças são transmissíveis entre algumas espécies animais, mas não outras", disse Witold Surewicz, professor do Departamento de Fisiologia e Biofísica da Faculdade de Medicina e responsável pelo estudo. autor sênior. "Nossas descobertas explicam como isso funciona."
O estudo foi publicado na
Nature Structural &Molecular Biology . Qiuye Li, pós-doutoranda na Escola de Medicina, foi o principal autor. O estudo foi de co-autoria de Christopher Jaoniec, professor de química e bioquímica da Ohio State University.
As doenças priônicas, também conhecidas como "encefalopatias espongiformes transmissíveis", são um grupo de distúrbios infecciosos de perda cerebral que incluem, entre outros, a doença de Creuzfeldt-Jakob em humanos, a encefalopatia espongiforme bovina (doença da vaca louca) em bovinos e a doença debilitante crônica em cervos. e alce.
Esses distúrbios fatais são únicos por causa de seu patógeno infeccioso – que não é um vírus, mas uma forma anormal da proteína príon.
Essa proteína deformada se reúne em longas fibrilas que se espalham agindo como um modelo - ou "semente" - que se liga à proteína príon normal e a força a mudar de forma para uma forma anormal e causadora de doenças, disse Surewicz.
Enquanto proteínas de formato anormal podem agir prontamente como moldes para converter proteínas de príons normais da mesma espécie, acredita-se que a semeadura cruzada seja restrita devido a diferenças dependentes da espécie na sequência de aminoácidos – os blocos básicos de construção de cada proteína.
"Parece que as barreiras - ou a falta delas - são totalmente ditadas pela capacidade da proteína priônica de uma espécie de adotar a estrutura das sementes de fibrilas priônicas de outra espécie", disse Li. "Isso, por sua vez, depende das diferenças de aminoácidos nas principais posições determinantes da estrutura".
Anteriormente, os cientistas do laboratório Surewicz desenvolveram um modelo empregando uma forma truncada de proteínas priônicas que lhes permitiu estudar no tubo de ensaio os mecanismos de propagação do prião, incluindo o fenômeno das barreiras de transmissibilidade (semeadura).
No entanto, o pleno entendimento desses mecanismos foi dificultado pela falta de informações sobre a estrutura das fibrilas infecciosas formadas por essas proteínas.
Os autores superaram essa limitação fundamental por meio do uso de uma técnica de microscopia crioeletrônica – um tipo de microscopia na qual as imagens são coletadas em temperatura muito baixa.
Ao analisar no computador milhares de imagens de fibrilas formadas por proteínas priônicas de modelo humano e de camundongo, eles determinaram a arquitetura dessas fibrilas em uma resolução próxima aos átomos individuais. Essa percepção estrutural permitiu que os pesquisadores explicassem, em termos estruturais precisos, por que existem barreiras de transmissibilidade de príons entre algumas espécies, enquanto essas barreiras não são observadas entre outras espécies.
"Mesmo que nossos estudos atuais tenham sido realizados usando um sistema modelo", disse Surewicz, "a capacidade de racionalizar e prever barreiras de transmissibilidade de príons com base em dados estruturais tem importantes implicações práticas, especialmente devido à atual epidemia de doenças crônicas entre alces e veados em partes dos Estados Unidos e Canadá, e preocupações crescentes sobre a transmissão potencial desta doença para humanos."
+ Explorar mais Proteínas corrompidas em foco:como a forma dá origem a variações de doenças cerebrais fatais
