Cientistas alcançam uma nova compreensão do processo de reparo por excisão de nucleotídeos
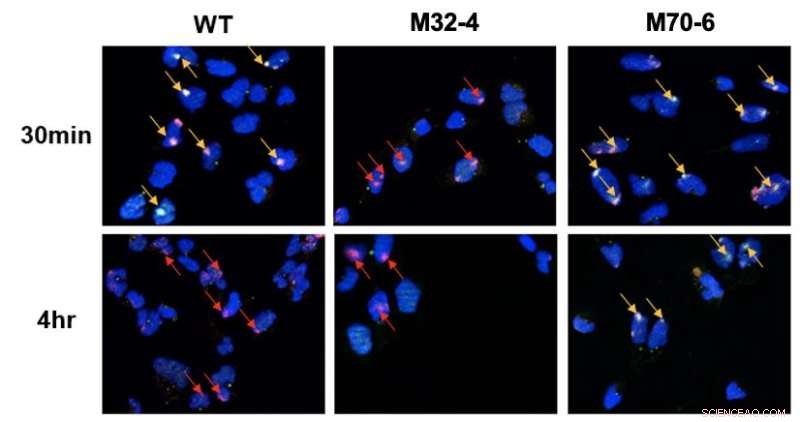
Papel distinto das interações de RPA32 e RPA70 com XPA em NER. As células foram irradiadas com UV e a co-localização de XPA com locais de dano UV foi visualizada por microscopia de fluorescência. Danos ao DNA são destacados por setas vermelhas e a co-localização de XPA com DNA UV é indicada por setas amarelas. Em células mutantes XPA-RPA32 (M32-4), observou-se redução do recrutamento de XPA para danos no DNA. Em células mutantes XPA-RPA70 (M70-6), o XPA permaneceu ligado aos locais danificados por um período prolongado. Isso indica que a interação do RPA32 com o XPA é necessária para o recrutamento do XPA para danos induzidos por UV, enquanto a interação do RPA70 com o XPA é importante para o posicionamento do XPA para a conclusão do NER. Crédito:Instituto de Ciências Básicas
O reparo por excisão de nucleotídeos (NER) é uma importante via conservada de reparo de DNA, que repara vários tipos de danos no genoma, como aqueles induzidos por luz ultravioleta e agentes ambientais. A disfunção nesta via pode ser prejudicial à saúde humana. Por exemplo, indivíduos com defeitos no NER sofrem de xeroderma pigmentoso, uma doença caracterizada por uma extrema disposição ao câncer de pele induzido pela luz solar devido à incapacidade de reparar o DNA danificado por UV.
Enquanto NER neutraliza a formação de câncer, também é importante para a terapia antitumoral. Muitos agentes antitumorais, como a cisplatina, induzem danos ao DNA que podem ser reparados por NER. Nesse contexto, o NER é um alvo farmacológico de interesse para melhorar os resultados da terapia do câncer. No nível molecular, o NER é uma máquina molecular altamente complexa e dinâmica, envolvendo mais de 30 proteínas que se montam em lesões de DNA para extirpar o dano e substituí-lo por DNA intacto. Este processo é guiado por interações proteína-proteína e proteína-DNA.
Uma equipe de pesquisadores liderada pelo Diretor Associado Orlando D. Schärer e pelo estudante de pós-graduação Kim Mihyun do Centro de Integridade Genômica do Instituto de Ciências Básicas da Coreia do Sul explorou essas interações. A equipe descobriu que duas proteínas-chave no NER, a proteína A do xeroderma pigmentoso (XPA) e as proteínas da proteína A de replicação (RPA), são necessárias para organizar o complexo de pré-incisão no NER.
As duas proteínas XPA e RPA são responsáveis pela organização do complexo NER depois de encontrado o dano no DNA. O presente estudo comparou variantes mutantes dessas duas proteínas para investigar como as duas proteínas se envolvem em uma interação fundamental para a via NER. Especificamente, descobriu-se que duas interfaces de interação entre XPA e RPA são críticas para o NER e têm papéis distintos no caminho. A interação de XPA com RPA32 é crucial para a associação inicial de XPA com danos no DNA, enquanto a interação entre XPA e RPA70 é importante para a conclusão de NER.
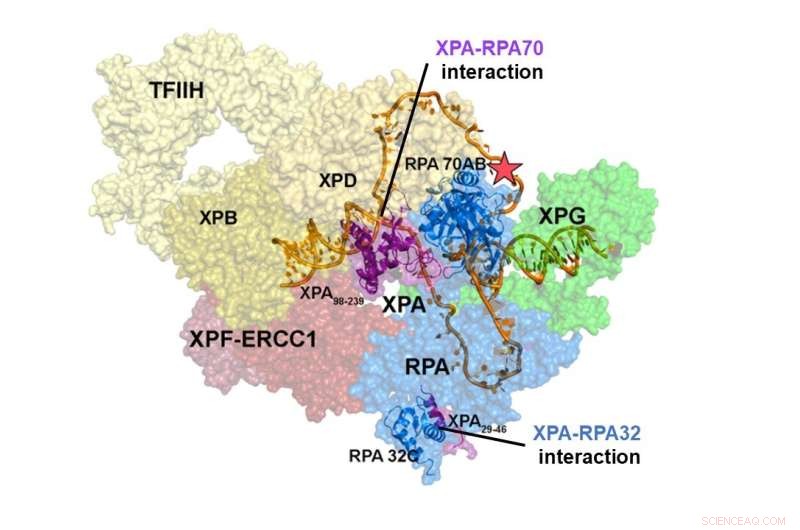
Estrutura do complexo de pré-incisão do NER. A interação de XPA e RPA70 está localizada no centro do complexo NER, enquanto o sítio de interação de XPA e RPA32 está na periferia. As interações entre XPA e RPA70 estabilizam o complexo de pré-incisão e contraem o DNA para assumir uma forma de U, que parece ser a forma ativa do complexo, permitindo remover o dano ao DNA. Crédito:Instituto de Ciências Básicas
Estudos estruturais integrativos de um complexo XPA-RPA-DNA revelaram como as interações das duas proteínas moldam o complexo NER e desencadeiam a excisão do dano. A interação de XPA e RPA32 ocorre na periferia do complexo, onde facilita a montagem inicial das proteínas no local do dano. A interação entre XPA e RPA70 está localizada no coração do complexo NER e força o DNA em forma de U. Isso permite que as duas junções ss/dsDNA fiquem localizadas próximas, permitindo que o complexo NER incide o DNA para remover o dano.
Schärer afirmou que seu "estudo revelou um novo modelo surpreendente do complexo NER e como a interação entre XPA e RPA molda sua arquitetura. A interrupção da interação entre XPA e RPA inibe o NER, e nosso estudo fornece um modelo de como essa interação pode ser alvo de pequenas moléculas para melhorar a terapia do câncer. Continuamos a buscar pesquisas de acompanhamento junto com nosso colaborador de longo prazo neste projeto, Prof. Walter Chazin da Universidade Vanderbilt."
Esta pesquisa foi publicada em
Proceedings of the National Academy of Sciences .
+ Explorar mais As etiquetas moleculares revelam como os lisossomos danificados são selecionados e marcados para eliminação

