Estudo mostra como as células imunológicas femininas mantêm seu segundo cromossomo X desligado
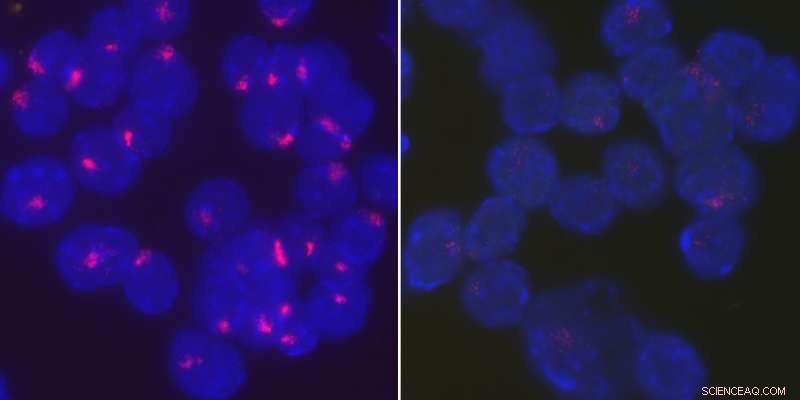 p Os pesquisadores descobriram que a proteína YY1 traz o RNA Xist de volta ao cromossomo X inativo para manter a inativação do cromossomo X em células B estimuladas. Ativado, as células B do tipo selvagem de camundongos fêmeas localizam firmemente o RNA Xist em seus cromossomos X inativos (à esquerda), enquanto o RNA Xist se torna disperso por todo o núcleo quando YY1 é excluído (direita). Crédito:Universidade da Pensilvânia
p Os pesquisadores descobriram que a proteína YY1 traz o RNA Xist de volta ao cromossomo X inativo para manter a inativação do cromossomo X em células B estimuladas. Ativado, as células B do tipo selvagem de camundongos fêmeas localizam firmemente o RNA Xist em seus cromossomos X inativos (à esquerda), enquanto o RNA Xist se torna disperso por todo o núcleo quando YY1 é excluído (direita). Crédito:Universidade da Pensilvânia
p As doenças autoimunes tendem a afetar mais as mulheres do que os homens e ter vários cromossomos X pode ser o principal motivo. Embora um processo chamado de inativação do cromossomo X sirva para equilibrar a dosagem do gene entre homens e mulheres, alguns genes no cromossomo "X inativo" nas células do sistema imunológico às vezes podem escapar desse processo, dar às mulheres uma dose extra de expressão gênica relacionada à imunidade. p Em um novo estudo, uma equipe da Universidade da Pensilvânia descreve como a inativação do cromossomo X é regulada nas células B do sistema imunológico à medida que se desenvolvem na medula óssea e quando encontram antígenos. Seu trabalho elucida uma dinâmica, mecanismo de duas etapas em mulheres pelo qual as células B sem os marcadores de inativação do cromossomo X recuperam essas modificações durante a ativação das células B, em um processo envolvendo o fator de transcrição YY1.
p "O que é notável é que as células B são as que produzem anticorpos e autoanticorpos, então eles são realmente cruciais tanto nas respostas imunológicas protetoras quanto na autoimunidade, "disse Montserrat C. Anguera, professor assistente do Departamento de Ciências Biomédicas da Escola de Medicina Veterinária da Penn e autor sênior do estudo. "Uma grande questão que permanece é, Por que essas células imunes priming para este cromossomo sejam reguladas de forma diferente e também, Se esses processos derem errado, como isso leva à autoimunidade e perda da autotolerância? "
p O estudo, publicado em
PLOS Genetics , foi liderado por Camille M. Syrett, estudante de doutorado no laboratório da Anguera. Coautores, representando Penn Vet e Penn's Perelman School of Medicine, eram Vishal Sinhava, Suchita Hodawadekar, Arpita Myles, Guanxiang Liang, Yue Zhang, Satabdi Nandi, Michael Cancro e Michael Atchison.
p Em um estudo no ano passado na revista
Proceedings of the National Academy of Sciences , Anguera e colegas descobriram que ingênuo, linfócitos femininos não estimulados, as células B e T do sistema imunológico, falhou em inativar completamente um cromossomo X. A pesquisa mostrou que isso acontecia porque Xist, uma longa transcrição de RNA não codificante bem conhecida por iniciar e manter o processo de inativação do cromossomo X, falhou em localizar no cromossomo X inativo. Quando as células imunológicas foram ativadas, ou preparado para responder à infecção, O RNA de Xist reapareceu no local adequado.
p "Vimos que as células B inativadas não têm essa nuvem de RNA, mas ele volta com a estimulação, "disse Syrett." Estávamos realmente interessados em determinar o que está trazendo o RNA Xist de volta. "
p Usando uma molécula rastreadora fluorescente, a equipe começou rastreando a localização de Xist no desenvolvimento de células B em camundongos fêmeas. Eles descobriram que os precursores das células B, como células-tronco hematopoiéticas e progenitores linfoides comuns, tinha padrões claros de RNA Xist no cromossomo X inativo. Mas, como esses precursores de células B seguiram um caminho de desenvolvimento para se tornarem células B, O RNA Xist primeiro pareceu desaparecer, então reaparece, mas apenas como alfinetadas difusas através do núcleo, em vez de serem localizadas no X inativo.
p Além disso, etiquetas de pequenas moléculas chamadas modificações de heterocromatina, que são conhecidos por manter a repressão gênica durante a inativação do cromossoma X, desapareceu durante o desenvolvimento das células B.
p "Pudemos ver essas mudanças realmente incomuns no nível de cromatina acontecendo no desenvolvimento de células B femininas, "Disse Anguera.
p Para descobrir como o Xist retornou ao X inativo após a ativação da célula B, como haviam mostrado no artigo PNAS do ano passado, os pesquisadores rastrearam o RNA Xist em células B em cultura. Eles descobriram que o reaparecimento ocorreu em duas fases distintas:entre quatro e 16 horas após as células serem estimuladas, as manchas de RNA Xist começaram a aparecer. E entre 16 e 30 horas após a estimulação, O RNA de Xist está concentrado exclusivamente no cromossomo X inativo. As modificações da heterocromatina pareceram aumentar e se localizar no X inativo também nesta segunda fase.
p O estudo anterior da equipe havia apontado para a proteína YY1 como desempenhando um papel no retorno de Xist em células B ativadas, então eles começaram a examiná-lo mais de perto neste trabalho. Atchison, líder em estudos de YY1 no desenvolvimento de células B, foi capaz de emprestar sua experiência para investigar o papel da proteína na inativação do cromossomo X.
p Quando os pesquisadores examinaram células B de camundongos sem YY1, eles viram níveis muito reduzidos de marcas de heterocromatina, bem como menos localização de ARN de Xist no X inativo.
p A equipe também observou evidências de que YY1 estava influenciando a expressão dos genes do cromossomo X. Quando eles deletaram YY1 de células masculinas e femininas e compararam genes que foram expressos diferencialmente no cromossomo X, eles encontraram 68 que eram específicos para mulheres, um que era específico para homens e 11 que eram compartilhados.
p Dos 68 genes específicos para mulheres, muitos estavam relacionados à imunidade, e pelo menos dois são conhecidos por serem superexpressos em células B femininas humanas em comparação com células B masculinas.
p Um outro conjunto de experimentos identificou a área de YY1 com atividade de ligação ao DNA como o domínio-chave desta proteína envolvida em trazer o RNA de Xist para o X inativo.
p "Parece estar agindo como uma amarra, trazendo o RNA Xist junto com o DNA do cromossomo X inativo, "Disse Anguera.
p Ela e seus colegas explorarão o papel de YY1 mais a fundo, usando amostras clínicas, bem como modelos de camundongos, olhar para a proteína em doenças como o lúpus para aprofundar sua compreensão de como a autoimunidade poderia resultar do "escape" de genes imunológicos da inativação do cromossomo X.
p "Se você deseja desenvolver uma terapia para doenças autoimunes, a ideia é, Como podemos levar Xist ao cromossomo X inativo e mantê-lo lá para manter a compensação da dosagem nessas células B. ", disse Anguera." Certamente YY1 está parecendo um alvo realmente promissor. "
