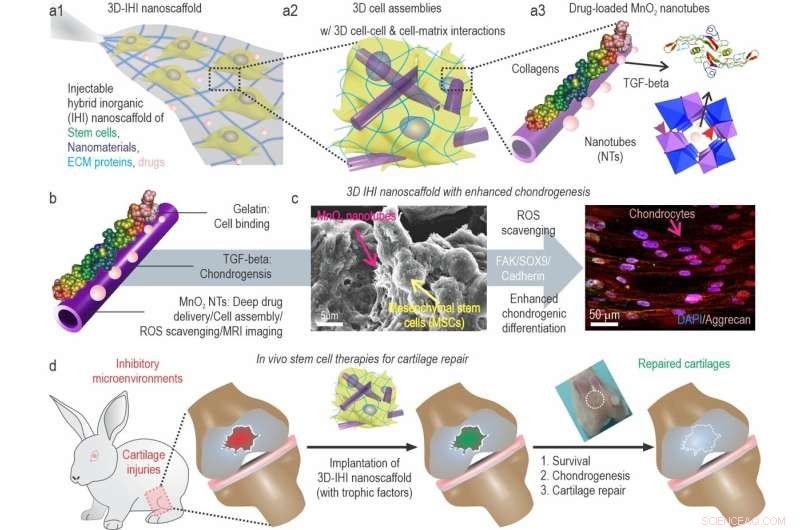
a) Uma ilustração esquemática do nanoscaffold 3D TGFβ-BMSC-IHI. b) A ilustração esquemática de MnO 2 revestido com gelatina e carregado com TGF-β3 NTs. c) A imagem do FESEM indicou que a maioria das BMSCs formam contatos com outras células e as estruturas 1D semelhantes a fibrilas, o que era semelhante às estruturas dos tecidos naturais. d) Ao remodelar o microambiente oxidativo, aumentando a viabilidade celular e a condrogênese das células transplantadas, a regeneração da cartilagem pode ser finalmente alcançada. Crédito:Science China Press
Um estudo liderado pelo Prof. Qiuyu Zhang (Universidade Politécnica do Noroeste), Prof. Ki-Bum Lee (Universidade Rutgers) e Prof. Liang Kong (Escola de Estomatologia, Quarta Universidade Médica Militar) estabeleceu um inorgânico híbrido injetável (IHI) montagem de células-tronco com modelo de nanoscaffold e aplicou-o à regeneração de defeitos de cartilagem de tamanho crítico.
As lesões da cartilagem são muitas vezes devastadoras e a maioria não tem cura devido à intrinsecamente baixa capacidade de regeneração dos tecidos da cartilagem. A ascensão dos sistemas de cultura de células-tronco 3D levou a avanços na biologia do desenvolvimento, modelagem de doenças e medicina regenerativa. Por exemplo, as células-tronco, uma vez transplantadas com sucesso, podem inicialmente secretar fatores tróficos para reduzir a inflamação nos locais das lesões da cartilagem e, em seguida, diferenciar-se em células da cartilagem (por exemplo, condrócitos) para restauração funcional.
No entanto, existem barreiras críticas a serem superadas antes que o potencial terapêutico das terapias com células-tronco possa ser realizado. O controle limitado sobre a diferenciação condrogênica de células-tronco in vivo muitas vezes resultou em resultados regenerativos comprometidos. Além disso, devido à prevalência de estresse oxidativo e inflamação no microambiente dos locais de lesão, as células-tronco frequentemente sofrem apoptose após a injeção.
Para enfrentar esses desafios, os pesquisadores demonstraram o desenvolvimento de um sistema de montagem de células-tronco 3D IHI com modelo de nanoscaffold para cultura e implantação avançada de células-tronco 3D. O nanoscaffold 3D-IHI monta rapidamente células-tronco em construções de tecidos injetáveis por meio de interações 3D célula-célula e célula-matriz personalizadas, fornece proteínas condrogênicas de forma profunda e homogênea nos sistemas de cultura 3D montados e induz de forma controlada a condrogênese por meio de efeitos nanotopográficos.
Uma vez implantado in vivo em um modelo de lesão de cartilagem de coelho, o nanoscaffold 3D-IHI modula efetivamente o microambiente dinâmico após lesão de cartilagem através da integração das sugestões regenerativas acima mencionadas e, simultaneamente, elimina espécies reativas de oxigênio usando uma composição à base de dióxido de manganês. Dessa forma, o reparo acelerado de defeitos da cartilagem com rápida reconstrução tecidual e recuperação funcional é realizado tanto a curto quanto a longo prazo. Dada a excelente versatilidade e resultado terapêutico da regeneração de cartilagem baseada em nanoscaffold 3D-IHI, pode fornecer meios promissores para avançar em uma variedade de aplicações de engenharia de tecidos.
A pesquisa foi publicada na
National Science Review .
-
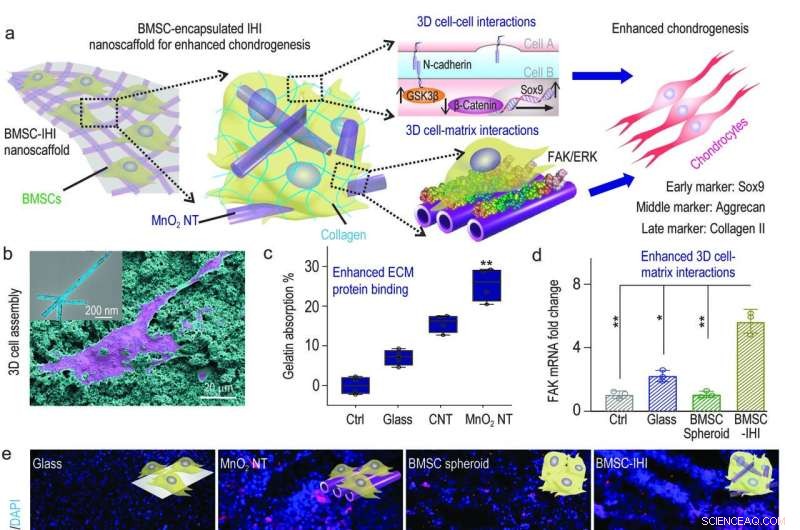
a) Um diagrama esquemático mostrando o nanoscaffold 3D-IHI pode aumentar a diferenciação condrogênica de BMSC através de uma sinergia entre as vias mediadas por N-caderina e FAK. b) As fortes interações entre MnO2 NTs e grupos funcionais comumente existentes em proteínas ECM apoiaram efetivamente a fixação celular, conforme demonstrado via imagem SEM. c) O ensaio de ácido bicinconínico indicou a absorção aumentada para gelatina de MnO2 nanotubo em comparação com grupos de controle. d) O MnO2 nanotube-templated assembly method significantly enhanced cell-matrix interaction as demonstrated through the up-regulated expression patterns of the FAK gene. e) Representative immunostaining images showing the improved chondrogenesis of BMSC in the BMSC-IHI nanoscaffold group compared to the control groups. Scale bar:50 μm. f-h) The expression of chondrogenic genes, including SOX9 (f), Aggrecan (g), and Col-II (h) were characterized via qRT-PCR measurement. Credit:Science China Press
-
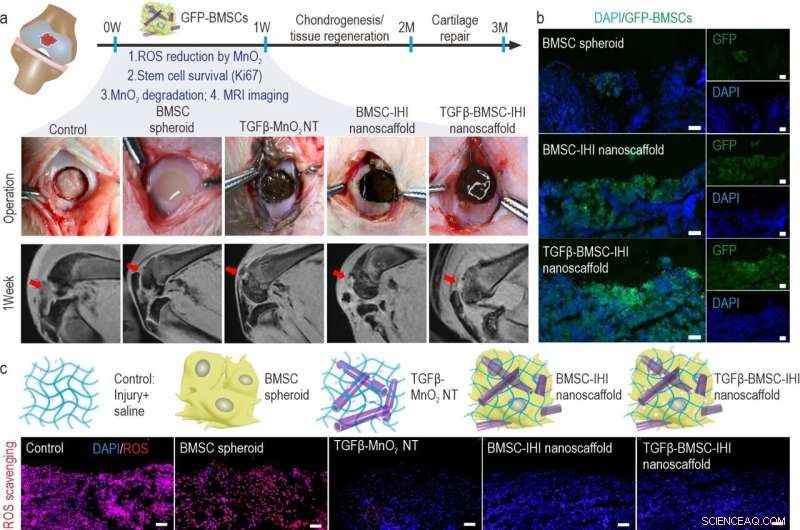
a) Schematic diagram illustrating the surgical process and timeline of cartilage repair. The degradation of MnO2 NTs and the regeneration process could be monitored via MRI. b) To identify our transplanted cells, BMSCs were genetically labeled with a green fluorescent protein (GFP). Scale bar:100 μm. c) The dramatically reduced red fluorescent signals of the ROS probe revealed that MnO2 NTs in the IHI nanoscaffold could effectively scavenge ROS in the defect area. Promoted cell proliferation was confirmed by the higher expression of proliferative marker Ki67 immunostaining. Scale bar:50 μm. d) The TGFβ-BMSC-IHI nanoscaffold could retain a significantly higher amount of cells after transplantation compared to other cell transplantation groups by quantifying the number of remaining GFP+ cells in (c). e) Histogram of the fluorescence intensity of ROS probe showed the effective consumption of ROS in the MnO2 NTs containing groups. f) Quantification of Ki67+ cells in the defects. The quantifications in (e) and (f) were generated based on the fluorescence intensities in (c). Credit:Science China Press
-
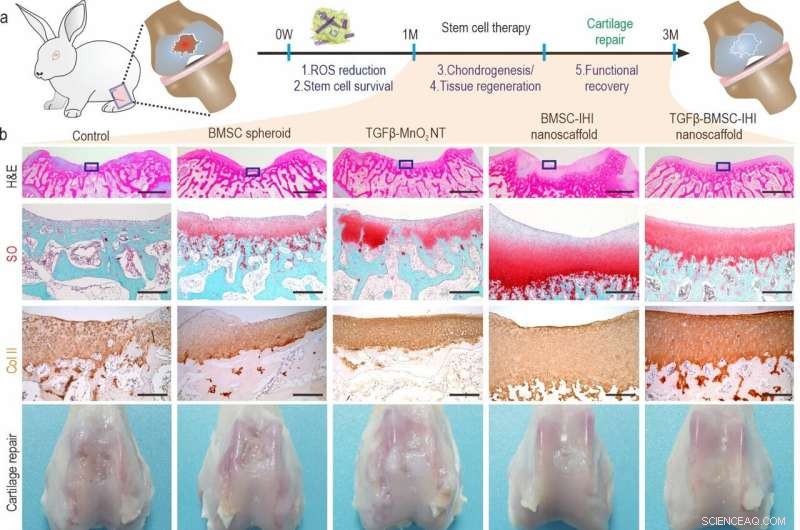
a) A schematic diagram illustrating the long-term (3 months) cartilage regeneration process. b) The in vivo cartilage regeneration was characterized through H&E, Safranin O staining, Col-II immunochemistry staining, as well as macroscopic views. Zoom out scale bar:2 mm, zoom in scale bar:200 μm. c-h) Quantifications of cartilage thickness (by H&E staining) (c), cellular components (by Safranin O staining) (d), ECM components (by Col II immunostaining) (e). Results of International Cartilage Repair Society (ICRS) macroscopic (f) and histologic scores (g) indicated significantly improved defect repair qualities in the TGFβ-BMSC-IHI nanoscaffold group. The reduced Osteoarthritis Research Society International (OARSI) scores revealed the TGFβ-BMSC-IHI nanoscaffold could prevent the deterioration of osteoarthritis (h). Credit:Science China Press
+ Explorar mais Discovery that TRPV4 gene regulates cartilage growth might yield future therapies for joint repair



