Nova pesquisa transforma proteínas transportadoras de glicose em forma solúvel em água
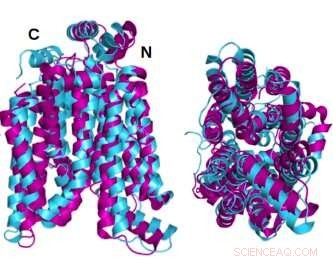
Dois ângulos da proteína transportadora de glicose GLUT1 (magenta) de estrutura cristalina superposta com a variante solúvel em água AlphaFold2 prevista por computador da mesma proteína (ciano) demonstram que a proteína cristalina e sua variante QTY solúvel em água compartilham notável semelhança estrutural. Crédito:Laboratório Shuguang Zhang, MIT
Todas as membranas celulares do corpo humano têm proteínas incorporadas que servem como sensores, mensageiros ou como meio de transporte e regulação de substâncias que entram e saem da célula. As proteínas de transporte, em particular, são pouco compreendidas devido à sua complexidade estrutural e à sua natureza hidrofóbica que as torna resistentes ao estudo. Ao mesmo tempo, essas proteínas de transporte, especialmente aquelas que regulam a glicose, desempenham um papel vital no crescimento de tumores cancerígenos.
Em um novo estudo, cientistas liderados pelo Dr. Shuguang Zhang, Ph.D. do MIT Media Lab, demonstram um método para prever rapidamente o design de estruturas hidrofílicas variantes das 14 proteínas de membrana de transporte de glicose nas células. Isso permitirá que os pesquisadores estudem mais facilmente as proteínas na água. Os cientistas confirmam a precisão das estruturas previstas comparando-as com imagens cristalográficas pré-existentes de duas das proteínas.
Eles esperam que uma melhor compreensão dessas proteínas de transporte de glicose acelere o desenvolvimento de anticorpos monoclonais terapêuticos para tratar a metástase do câncer. Isso essencialmente mataria as células cancerígenas, bloqueando os transportadores de glicose.
“A maioria das células cancerígenas aumenta significativamente sua expressão e produção de transportadores de glicose, chamados GLUTs, por sua demanda insaciável de energia”, diz Eva Smorodina, estudante de graduação em biologia estrutural no Greiff Lab, Universidade de Oslo, primeira autora de um artigo sobre o estudo publicado em 27 de junho na
QRB Discovery . "Atualmente, quase não há medicamentos eficazes para bloquear os GLUTs, pois eles têm uma estrutura desafiadora".
As estruturas complexas dos GLUTs compreendem 12 hélices hidrofóbicas transmembrana embutidas na membrana. Em seu estado nativo ou cristalino, as estruturas hidrofóbicas devem ser colocadas em um detergente ou reagente especial para estudo de laboratório, ou perderão sua estrutura. E com as proteínas, estrutura e função estão indelevelmente relacionadas.
"Estudar essas proteínas em detergente é como usar luvas pesadas para montar um relógio caro ou tocar violino", diz o Dr. Zhang, um dos poucos cientistas biomédicos para quem o estudo de proteínas de membrana é tão atraente quanto vital para nossa compreensão. de células cancerosas. Ele começou a trabalhar em proteínas de membrana no início dos anos 2000. "Poucas pessoas estavam estudando essas proteínas de membrana", diz o Dr. Zhang. "Eles são como uma batata quente", diz ele, por causa de sua resistência inerente ao estudo.
O novo trabalho é baseado no sucesso do Dr. Zhang há quatro anos, quando ele e uma equipe realizaram o que o Dr. Zhang vinha trabalhando há quase uma década:eles projetaram um método maravilhosamente simples chamado código QTY para transformar uma proteína hidrofóbica de membrana celular em uma proteína hidrofílica substituindo muitos aminoácidos hidrofóbicos.
O código QTY é nomeado para os símbolos dos três aminoácidos - glutamina (Q), treonina (T) e tirosina (Y) - que são substituídos por quatro aminoácidos hidrofóbicos:leucina (L), isoleucina (I), valina ( V) e fenilalanina (F). Nenhum desses aminoácidos carrega uma carga, o que torna a substituição benigna. A estrutura é essencial para o funcionamento das proteínas, e a substituição não altera a estrutura.
No último estudo, o Dr. Zhang e sua equipe aplicam o código QTY às 14 proteínas de membrana de transporte de glicose que transportam açúcar para as células. Eles usaram o novo programa AlphaFold2, um programa computacional baseado em inteligência artificial desenvolvido pela empresa DeepMind, que pode prever com precisão e rapidez como as proteínas se dobram. Dr. Zhang e sua equipe usaram o código QTY com o AlphaFold2 de código aberto para prever as formas helicoidais alfa das 14 proteínas GLUT tanto em suas formas hidrofóbicas naturais quanto em suas formas solúveis em água alteradas pelo código QTY.
As estruturas de estado cristalino ou nativo de dois dos GLUTs - 1 e 3 - foram reveladas anteriormente por outros pesquisadores usando cristalografia de raios-X. Para fundamentar sua própria metodologia, a equipe do Dr. Zhang primeiro previu a estrutura hidrofílica desses dois GLUTs aplicando as substituições de aminoácidos do código QTY e deixando o AlphaFold2 prever as formas das proteínas. Fê-lo com grande precisão. As imagens hidrofóbicas e hidrofílicas superpostas são quase idênticas.
A equipe acompanhou essa confirmação combinando o código QTY e o AlphaFold2 para prever as estruturas hidrofílicas dos outros 12 GLUTs - em tempo recorde. "Em 2018, levou de quatro a cinco semanas usando um cluster de computador de alta velocidade para simular qualquer estrutura de proteína", diz o Dr. Zhang. "Agora, com o AlphaFold2, podemos usar um computador do Google gratuitamente, e ele simula as proteínas transmembranares em horas. Algumas proteínas pequenas demoram menos de uma hora."
"Este estudo sobre transportadores de glicose de membrana humana e suas variantes QTY solúveis em água do laboratório Zhang no MIT é fascinante", diz o professor Joel Sussman do Instituto Weizmann de Ciências em Rehovot, Israel, que não esteve envolvido no trabalho. "Ele fornece visualização experimental via cristalografia de raios-X e previsão de IA usando AlphaFold2 para ver, pela primeira vez, em resolução atômica, as diferenças entre hélices hidrofóbicas que odeiam a água e hélices hidrofílicas que adoram a água. passo no uso do método de código QTY para estudar proteínas transmembranares multispan e outras proteínas agregadas por meio de suas variantes solúveis em água, e provavelmente terá um enorme impacto no campo da biotecnologia".
O professor do MIT Robert Langer, cujo trabalho em engenharia biomédica é altamente celebrado, diz:"A [
Descoberta QRB ] é excelente e acredito que tem potencial para ajudar muitos pacientes com câncer." O professor Langer não esteve envolvido na pesquisa.
Autores da
Descoberta QRB papel são Dr. Zhang e Smorodina; Fei Tao e Rui Qing da Shanghai Jiaotong University (Dr. Qing foi anteriormente pesquisador de pós-doutorado no MIT Media Lab e mais tarde um cientista pesquisador do Koch Institute for Integrative Cancer Research no MIT); Dr. Steve Yang um ex-aluno do MIT agora na PT Metiska Farma na Indonésia; e Dr. David Jin, M.D., Ph.D. da Avalon GloboCare Corp., que estimulou o Dr. Zhang a aplicar o código QTY ao estudo de células cancerosas. Avalon GloboCare também financiou a pesquisa.
Dr. Jin diz que espera - mas isso não faz parte do estudo atual - que pesquisas futuras sejam capazes de alterar geneticamente as membranas de passagem de glicose para desenvolver novos alvos terapêuticos.
"Agora nossas únicas opções para o tratamento do câncer são cirurgia, quimioterapia ou terapia com pequenas moléculas", diz o Dr. Jin. "No futuro, pode ser possível pegar a célula T de um paciente, um componente do sistema imunológico, e modificá-la geneticamente no laboratório para que possa funcionar quase como um sistema GPS de pesquisa de câncer com capacidade de ataque de tumor. "
+ Explorar mais Cientistas alteram proteínas de membrana para torná-las mais fáceis de estudar
