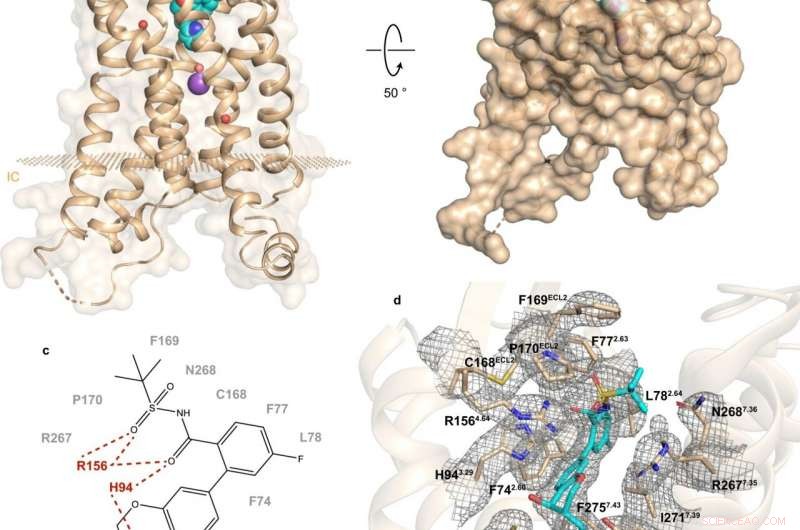
Fig. 1:Estrutura e local de ligação de hBLT1. Crédito:Michaelian, N., et al. Nature Communications , https://doi.org/10.1038/s41467-021-23149-1
Pesquisadores da University of Southern California, Merck &Co., Skoltech, MIPT, UCLA, e a Université de Sherbrooke determinaram a estrutura do receptor 1 de leucotrieno B4 humano, envolvido em processos inflamatórios, infeccioso, alérgico, e doenças tumorigênicas. Publicado em Nature Communications , a análise da estrutura revela como o receptor reconhece seus parceiros de ligação e interage com eles. Isso abre caminhos para o desenvolvimento de medicamentos melhores que tenham como alvo o receptor para tratar o diabetes tipo 2 e outras patologias.
Receptores são os equipamentos baseados em proteínas que as células usam para receber e transmitir sinais. Um receptor é ativado quando se liga a uma molécula mensageira chamada agonista, após o que ele retransmite o sinal, que regula alguma função biológica. Antagonistas, por contraste, desligue o receptor quando ligado. Agonistas e antagonistas são conhecidos coletivamente como ligantes.
O receptor 1 de leucotrieno B4 humano, ou hBLT1, regula os processos relacionados à inflamação, como o recrutamento de células T, bem como a proliferação e migração de células musculares lisas. Esse receptor tem sido associado a doenças, incluindo asma, gripe, artrite, aterosclerose, diabetes, e câncer.
Desde sua descoberta em 1997, tem havido uma série de tentativas para desenvolver ligantes de hBLT1 para uso como drogas, mas eles tinham muitos efeitos colaterais, baixa eficácia, e o corpo demorou comparativamente mais tempo para eliminá-los. Uma explicação provável para isso é que os ligantes de hBLT1 usados não são específicos para esse receptor e se envolvem em outras interações indesejadas. Aprender mais sobre a estrutura do receptor e como ele se liga aos ligantes pode permitir que os farmacologistas projetem melhor, drogas mais seletivas.
Um estudo recente realizado por uma colaboração russo-americana-canadense lança luz sobre a composição e o funcionamento de hBLT1. Vadim Cherezov, professor de Química da USC e chefe do Laboratório de Biologia Estrutural do MIPT dos GPCRs, comentou:"Determinamos a estrutura de cristal de resolução de 2,9 angstrom do receptor hBLT1 em complexo com um antagonista seletivo, MK-D-046, desenvolvido pela Merck &Co. Esta estrutura deve ajudar a projetar racionalmente melhores terapêuticas para tratar o diabetes tipo 2 e outras condições inflamatórias. "
A determinação da estrutura foi complementada por estudos de mutagênese dirigida ao local e docking - um método experimental e computacional, respectivamente. De acordo com o professor assistente da Skoltech, Petr Popov, "isso tornou possível revelar os principais determinantes das interações intermoleculares entre o receptor e os ligantes."
A análise da estrutura de hBLT1 revela como o receptor reconhece e liga os ligantes, sugerindo um canal de acesso ao ligante putativo enterrado na membrana do receptor. Mais especificamente, as descobertas sugerem as possíveis maneiras pelas quais o receptor pode se ligar a seus agonistas endógenos. Isso é, compostos produzidos naturalmente pelo corpo para se ligar a esse receptor e ativá-lo.
Ao melhorar nossa compreensão da estrutura e funcionamento de hBLT1, o estudo abre possibilidades para o desenho de medicamentos com base na estrutura.