Os átomos de rutênio apoiados em platina são extremamente ativos para produzir hidrogênio. Crédito:HKUST
Um grupo de pesquisadores da Universidade de Ciência e Tecnologia de Hong Kong (HKUST) e da Universidade de Xiamen revelou novos entendimentos de como os átomos de rutênio da superfície podem melhorar a evolução do hidrogênio e as atividades de oxidação da platina. Esta descoberta abre um novo espaço para o design racional de catalisadores mais avançados para aplicações de eletrolisadores e células de combustível.
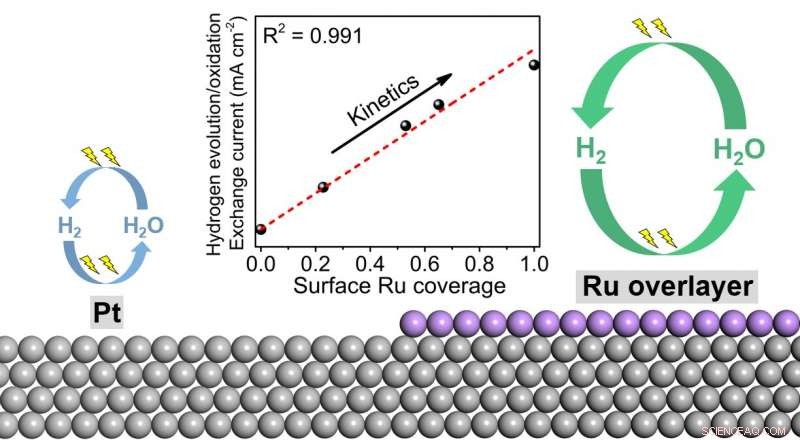
O hidrogênio é um carreador de energia limpa que não contém carbono. Acredita-se que ele desempenhe um papel essencial em nossa futura sociedade sustentável. O hidrogênio pode ser produzido a partir da água por meio da reação de evolução de hidrogênio (HER) em um eletrolisador usando energias renováveis, e consumido por meio de uma reação de oxidação de hidrogênio (HOR) em uma célula de combustível para gerar eletricidade. Infelizmente, essas duas reações são bem conhecidas cineticamente lentas em meios alcalinos, mesmo nos catalisadores de platina mais ativos. As taxas de reação lentas limitam a eficiência desses dois dispositivos eletroquímicos e impedem sua ampla adoção. Sabe-se que as taxas de reação de HER / HOR em platina podem ser melhoradas por modificação de superfície ou liga com rutênio. Contudo, os mecanismos para essa promoção vêm sendo debatidos há mais de décadas. Parte dos motivos é a falta de observação direta do comportamento dos átomos de hidrogênio nas superfícies dos catalisadores.
Para revelar o enigma de altas atividades HER / HOR em catalisadores bimetálicos de platina-rutênio, uma equipe de pesquisa liderada pelo Prof. Minhua Shao, Departamento de Engenharia Química e Biológica e Instituto de Energia da HKUST, aplicou recentemente a poderosa espectroscopia de absorção infravermelha (SEIRAS) para monitorar diretamente a força de ligação do importante intermediário de reação, átomos de hidrogênio em várias superfícies. Por meio da combinação eletroquímica, espectroscópico, e estudos teóricos confirmaram que os átomos de rutênio da superfície interagindo com a platina sub-superficial é uma ordem de magnitude mais ativa do que a platina, ou seja, os átomos de rutênio, em vez de platina, são os principais locais ativos neste sistema.
"Trabalhos anteriores usaram principalmente técnicas eletroquímicas e de caracterização convencionais, que não pode monitorar diretamente o comportamento de adsorção de intermediários da reação de hidrogênio. Nesse trabalho, usamos a poderosa espectroscopia de absorção infravermelha com superfície melhorada, que está entre as poucas técnicas que podem "ver" diretamente os átomos de hidrogênio na superfície, e nos fornece informações mais diretas sobre como o rutênio melhora a atividade ", disse o Prof. Shao." Este trabalho elimina a teoria mais difundida de que o efeito bifuncional na interface entre a platina e o rutênio é a causa do aumento das atividades, e abre novas direções no design futuro de catalisadores HER / HOR mais avançados, o que pode, conseqüentemente, reduzir o uso de metais preciosos em eletrolisadores de água e células de combustível de hidrogênio. "
Este trabalho é parte do projeto do Fundo de Pesquisa Colaborativa recém-fundado liderado pelo Prof. Shao "Desenvolvimento de células de combustível de membrana alcalina de alto desempenho e longa vida, "e constitui uma subseção importante da pesquisa fundamental para todo o projeto. Os trabalhos seguintes sobre o desenvolvimento de eletrocatalisadores bimetálicos de platina-rutênio de alto desempenho práticos e de alto desempenho com base nessas descobertas estão em andamento.
Este estudo foi publicado recentemente em Catálise Natural intitulado "O papel do rutênio na melhoria da cinética da oxidação do hidrogênio e das reações de evolução da platina."