Rumo ao desenvolvimento de medicamentos para doenças relacionadas ao envelhecimento
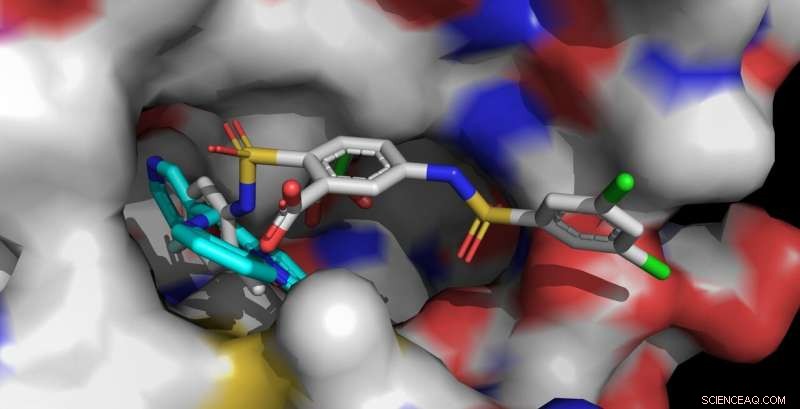 p Os ativadores Sirt6 UBCS039 (ciano, frente à esquerda) e MDL-801 (multicolorido, frontal direito) são ancorados no mesmo bolso de ligação do Sirt6. A molécula MDL-801 mais longa também contata áreas de superfície adjacentes e interage mais fortemente com Sirt6. Crédito:Clemens Steegborn
p Os ativadores Sirt6 UBCS039 (ciano, frente à esquerda) e MDL-801 (multicolorido, frontal direito) são ancorados no mesmo bolso de ligação do Sirt6. A molécula MDL-801 mais longa também contata áreas de superfície adjacentes e interage mais fortemente com Sirt6. Crédito:Clemens Steegborn
p Na busca por maneiras de combater eficazmente as doenças humanas relacionadas à idade, a enzima sirtuin 6 (Sirt6) tornou-se recentemente um foco de pesquisas bioquímicas. Uma ativação direcionada de Sirt6 pode prevenir ou mitigar tais doenças, por exemplo, alguns tipos de câncer. Em um artigo para o jornal
Nature Chemical Biology , bioquímicos da Universidade de Bayreuth agora mostraram como a pequena molécula MDL-801 se liga à enzima Sirt6 e influencia sua atividade. Essas descobertas ajudam no desenvolvimento de novos medicamentos. p O corpo humano contém sete sirtuins diferentes, denominado Sirt1 a Sirt7. Essas enzimas desempenham um papel essencial na regulação do metabolismo e nas reações de estresse. Nos últimos anos, a equipe de pesquisa liderada pelo Prof. Dr. Clemens Steegborn da Universidade de Bayreuth mostrou em vários artigos de pesquisa como o Sirt6 pode ser ativado por pequenas moléculas. Com seu estudo, agora publicado em
Nature Chemical Biology , Steegborn e seu assistente de pesquisa, Dr. Weijie. Você acompanhou essas descobertas. Eles descobriram que a molécula MDL-801 interage com Sirt6 usando uma característica estrutural única desta enzima:uma bolsa de ligação incomumente larga que é facilmente acessível de fora e normalmente está envolvida na interação com proteínas do substrato. Esta cavidade molecular continua em um canal aberto que leva ao centro catalítico de Sirt6. É neste canal, característica de Sirt6, que o MDL-801 ancora quando ativa a enzima. Principalmente por meio de estudos de atividades e análises de estrutura de raios-X, Steegborn e You foram capazes de identificar o local de ligação e os processos moleculares envolvidos na ativação de Sirt6 pelo MDL-801.
p Como os bioquímicos de Bayreuth já mostraram em estudos anteriores, as substâncias ativas UBCS039, quercetina, e a fluvastatina também são capazes de ativar Sirt6. Para fazer isso, eles usam o mesmo canal aberto em que o MDL-801 é acoplado. Essa cavidade alongada também é chamada de canal de acila. Assim que Sirt6 estiver em um estado ativado, ele separa os grupos acila das proteínas. Deste modo, isso influencia, entre outras coisas, a síntese de proteínas controladas por genes. Portanto, as descobertas sobre a ativação de Sirt6 oferecem pistas valiosas para o desenvolvimento de substâncias ativas que podem neutralizar doenças relacionadas ao envelhecimento - por exemplo, o desenvolvimento de tumores.
p "Todas as pequenas moléculas para as quais até agora pudemos demonstrar um efeito de ativação em Sirt6 usam o canal de acila para se ligar a Sirtuin 6. E, embora suas estruturas químicas sejam muito diferentes, eles fazem isso de maneiras muito semelhantes. Isso nos abre a oportunidade de usar os detalhes de suas respectivas interações para ajustar os compostos de ativação. Essas drogas seriam então capazes de regular a Sirt6 de uma maneira específica. Deste modo, eles podem ser usados de forma direcionada para prevenir ou curar doenças associadas ao processo de envelhecimento, "diz Steegborn.
p Com seu novo estudo, Steegborn e você refutaram uma declaração importante que um grupo de pesquisa em Xangai publicou em
Nature Chemical Biology em 2018. Neste artigo, MDL-801 foi descrito como um novo ativador Sirt6. Uma estrutura cristalográfica de raios-X foi usada para mostrar que o MDL-801 se liga a uma seção molecular diferente de Sirt6 do que outros ativadores. "Esta estrutura, que resultou de uma má interpretação dos dados experimentais, enganou várias equipes de pesquisa desde sua publicação. Nosso estudo corrige esse erro e, portanto, torna possível trabalhar de forma eficiente em ativadores aprimorados, "diz Steegborn.
