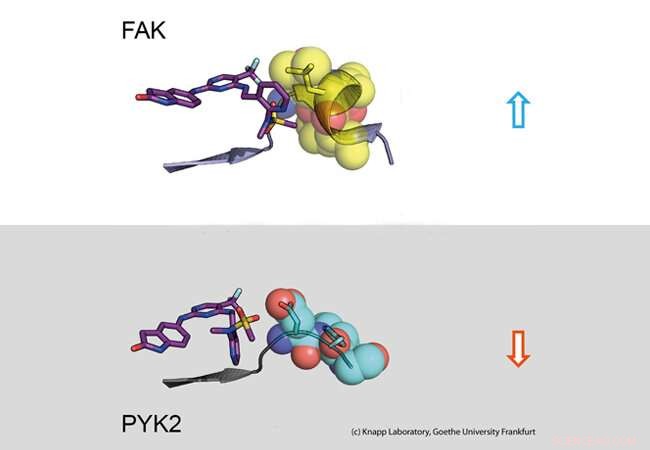
Parte superior:longo tempo de residência. Um inibidor (esquerda:modelo stick) liga-se à molécula sinalizadora FAK (direita:parte da proteína FAK representada como modelo calotte com esferas). A mudança estrutural de FAK causa contatos hidrofóbicos (amarelo, o chamado motivo DFG) e um noivado de longa duração. Parte inferior:Tempo de residência curto. A proteína sinalizadora PYK2 não muda sua estrutura após a ligação ao inibidor, resultando assim em uma rápida dissociação do inibidor. Crédito:Knapp Laboratory, Goethe University Frankfurt
Muitos medicamentos anticâncer bloqueiam os sinais nas células cancerosas que ajudam as células degeneradas a se multiplicar de forma descontrolada e se desprender do tecido. Por exemplo, bloqueando a proteína de sinalização FAK, uma chamada quinase, faz com que as células do câncer de mama se tornem menos móveis e, portanto, menos propensas a metástases. O problema é que quando o FAK é bloqueado por um inibidor, a proteína de sinalização intimamente relacionada PYK2 torna-se muito mais ativa e, portanto, assume algumas das tarefas de FAK. O ideal seria, portanto, um inibidor que inibisse FAK e PYK2 da mesma forma pelo maior tempo possível.
Uma equipe internacional liderada pelo químico farmacêutico Prof. Stefan Knapp, da Goethe University, investigou uma série de inibidores de FAK especialmente sintetizados. Todos os inibidores se ligaram à proteína FAK aproximadamente na mesma taxa. Contudo, eles diferiam na duração da ligação:o inibidor mais eficaz permaneceu ligado à proteína de sinalização FAK por mais tempo.
Usando análises biológicas estruturais e moleculares, bem como simulações de computador, a equipe de pesquisa descobriu que a ligação de inibidores que permanecem no bolso de ligação da FAK por um longo tempo induz uma mudança estrutural. Assim, através da ligação desses inibidores, FAK muda sua forma e forma um específico, estrutura repelente de água em locais de contato com o inibidor, comparável a um abraço íntimo.
A proteína PYK2 intimamente relacionada, por outro lado, permaneceu relativamente rígido, e embora o inibidor de FAK mais eficaz também bloqueie PYK2, seu efeito foi significativamente mais fraco devido à rápida dissociação dos inibidores do local de ligação. Interessantemente, simulações de computador foram capazes de prever a cinética de ligação muito bem, fornecer um método para simulação precisa de taxas de dissociação de drogas para futura otimização de candidatos a drogas.
O Prof. Stefan Knapp explica, "Porque agora temos um melhor entendimento dos mecanismos moleculares da interação de inibidores potentes dessas duas quinases, Esperamos poder usar simulações de computador para prever melhor os tempos de residência de inibidores e candidatos a medicamentos no futuro. Até aqui, pouca atenção tem sido dada às propriedades cinéticas da ligação do fármaco. Contudo, esta propriedade surgiu agora como um parâmetro importante para o desenvolvimento de drogas mais eficazes que são projetadas para inibir suas proteínas-alvo - como no caso de FAK e PYK2 - não apenas potentemente, mas também por um longo tempo. "