Estudo mostra que ajustar uma camada de átomos na superfície de um catalisador pode fazer com que funcione melhor
 p Uma ilustração combina dois tipos possíveis de camadas de superfície para um catalisador que realiza a reação de divisão da água, a primeira etapa na fabricação de combustível de hidrogênio. A superfície cinza, principal, é óxido de lantânio. A superfície colorida é óxido de níquel; um rearranjo de seus átomos durante a realização da reação o tornou duas vezes mais eficiente, um fenômeno que os pesquisadores esperam explorar para projetar catalisadores melhores. Os átomos de lantânio são representados em verde, níquel em azul e oxigênio em vermelho. Crédito:CUBE3D Graphic
p Uma ilustração combina dois tipos possíveis de camadas de superfície para um catalisador que realiza a reação de divisão da água, a primeira etapa na fabricação de combustível de hidrogênio. A superfície cinza, principal, é óxido de lantânio. A superfície colorida é óxido de níquel; um rearranjo de seus átomos durante a realização da reação o tornou duas vezes mais eficiente, um fenômeno que os pesquisadores esperam explorar para projetar catalisadores melhores. Os átomos de lantânio são representados em verde, níquel em azul e oxigênio em vermelho. Crédito:CUBE3D Graphic
p Cientistas que elaboraram um catalisador à base de níquel usado na fabricação de combustível de hidrogênio construíram uma camada atômica de cada vez para obter controle total sobre suas propriedades químicas. Mas o material acabado não se comportou como eles esperavam:enquanto uma versão do catalisador fazia seu trabalho, a camada superior de átomos reorganizada para formar um novo padrão, como se os ladrilhos quadrados que cobrem o chão tivessem subitamente mudado para hexágonos. p Mas tudo bem, eles relataram hoje, porque compreender e controlar essa transformação surpreendente dá a eles uma nova maneira de ligar e desligar a atividade catalítica e tornar bons catalisadores ainda melhores.
p A equipe de pesquisa, liderado por cientistas da Universidade de Stanford e do Laboratório Nacional do Acelerador SLAC do Departamento de Energia, descreveu seu estudo em
Materiais da Natureza hoje.
p "Os catalisadores podem mudar muito rapidamente durante o curso de uma reação, e entender como eles se transformam de uma fase inativa para uma fase ativa é crucial para projetar catalisadores mais eficientes, "disse Will Chueh, um investigador do Instituto de Stanford para Ciências de Materiais e Energia (SIMES) no SLAC que liderou o estudo. "Essa transformação nos dá o equivalente a um botão que podemos girar para ajustar o comportamento deles."
p
Dividindo a água para fazer combustível de hidrogênio
p Os catalisadores ajudam as moléculas a reagir sem serem consumidas na reação, para que possam ser usados continuamente. Eles são a espinha dorsal de muitos dispositivos de energia verde.
p Este catalisador particular, óxido de níquel de lantânio ou LNO, é usado para dividir a água em hidrogênio e oxigênio em uma reação alimentada por eletricidade. É a primeira etapa na geração de combustível de hidrogênio, que tem um enorme potencial para armazenar energia renovável da luz solar e de outras fontes em forma líquida, rica em energia e fácil de transportar. Na verdade, vários fabricantes já produziram carros elétricos movidos a células de combustível de hidrogênio.
p Mas esta primeira etapa também é a mais difícil, disse Michal Bajdich, um teórico do Centro SUNCAT para Ciência de Interface e Catálise no SLAC, e os pesquisadores têm procurado materiais baratos que façam isso com mais eficiência.
p Uma vez que as reações ocorrem na superfície de um catalisador, pesquisadores têm tentado projetar precisamente essas superfícies para que promovam apenas uma reação química específica com alta eficiência.
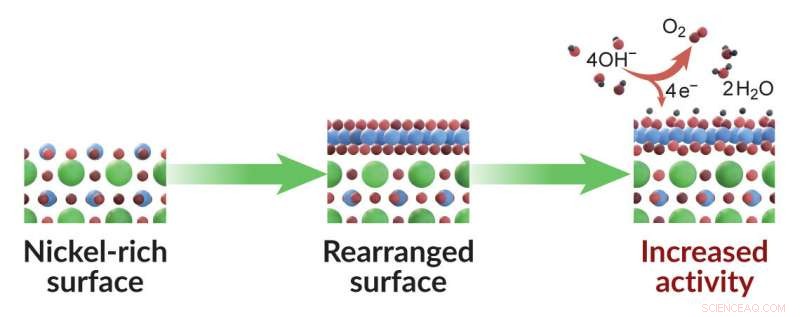 p Um novo estudo mostra como o ajuste da camada superficial de um catalisador pode fazer com que ele funcione melhor. Este catalisador específico é usado para dividir a água, a primeira etapa na fabricação de combustível de hidrogênio. Consiste em camadas alternadas de materiais ricos em níquel (esferas azuis) e lantânio (esferas verdes; as esferas vermelhas representam átomos de oxigênio). Quando o material é cultivado em temperaturas relativamente baixas, de modo que uma camada rica em níquel fica no topo (à esquerda), os átomos nessa camada superficial se reorganizam durante a reação de divisão da água (meio) de uma forma que lhes permite realizar a reação de forma mais eficiente (direita). Este resultado surpreendente oferece aos cientistas uma nova maneira de sintonizar a atividade catalítica e desenvolver catalisadores melhores. Crédito:Tomas Duchon / Forschungszentrum Juelich
p Um novo estudo mostra como o ajuste da camada superficial de um catalisador pode fazer com que ele funcione melhor. Este catalisador específico é usado para dividir a água, a primeira etapa na fabricação de combustível de hidrogênio. Consiste em camadas alternadas de materiais ricos em níquel (esferas azuis) e lantânio (esferas verdes; as esferas vermelhas representam átomos de oxigênio). Quando o material é cultivado em temperaturas relativamente baixas, de modo que uma camada rica em níquel fica no topo (à esquerda), os átomos nessa camada superficial se reorganizam durante a reação de divisão da água (meio) de uma forma que lhes permite realizar a reação de forma mais eficiente (direita). Este resultado surpreendente oferece aos cientistas uma nova maneira de sintonizar a atividade catalítica e desenvolver catalisadores melhores. Crédito:Tomas Duchon / Forschungszentrum Juelich
p
Materiais de construção, uma camada atômica de cada vez
p O LNO investigado neste estudo pertence a uma classe de materiais catalíticos promissores conhecidos como perovskitas, nomeado após um mineral natural com uma estrutura atômica semelhante.
p Christoph Baeumer, que veio para o SLAC como Marie Curie Fellow da Aachen University na Alemanha para realizar o estudo, preparou LNO no que é conhecido como um filme fino epitaxial - um filme crescido em camadas atomicamente finas de uma forma que cria um arranjo extraordinariamente preciso de átomos.
p Dividindo seu tempo entre a Califórnia e a Alemanha, Baeumer fez duas versões do filme em temperaturas diferentes - uma com uma superfície rica em níquel e outra com uma superfície rica em lantânio. Em seguida, a equipe de pesquisa executou todas as versões por meio da reação de divisão da água para comparar o seu desempenho.
p "Ficamos surpresos ao descobrir que os filmes com superfícies ricas em níquel realizaram a reação duas vezes mais rápido, "Baeumer disse.
p
Ajustando a superfície de um catalisador para melhor desempenho
p Para descobrir o porquê, a equipe levou os filmes ao Laboratório Nacional Lawrence Berkeley do DOE, onde um grupo liderado por Slavomir Nemsak olhou para sua estrutura atômica com raios-X na Fonte de Luz Avançada.
p “Foi surpreendente que a diferença entre o 'bom' e o 'mau' catalisador estivesse apenas na última camada atômica dos filmes, "Nemsak disse. Essas investigações também revelaram que em filmes com camadas superficiais ricas em níquel que foram preparados em temperaturas mais frias, a camada superior de átomos transformada em algum ponto durante a reação de divisão da água, e esse novo arranjo impulsionou a atividade catalítica.
p Enquanto isso, Jiang Li, pesquisador de pós-doutorado e teórico da SUNCAT, realizou estudos computacionais desse sistema muito complexo usando o Centro de Computação Científica de Pesquisa Energética Nacional (NERSC) do Berkeley Lab. Suas conclusões concordam com os resultados experimentais, prevendo que a versão do catalisador com a superfície transformada - de um padrão cúbico para um hexagonal - seria a mais ativa e estável.
p Bajdich disse, "É a transformação da superfície rica em níquel impulsionada pela forma como o catalisador é preparado, ou pelas mudanças que sofre enquanto realiza a reação de divisão da água? Isso é muito difícil de responder. Parece que ambos têm que ocorrer. "
p Embora este catalisador específico não seja o melhor do mundo para dividir a água em hidrogênio e oxigênio, ele disse, descobrir como uma transformação de superfície aumenta sua atividade é importante e pode ser aplicada a outros materiais também.
p "Se pudermos desvendar os segredos dessa transformação para que possamos ajustá-la com precisão, " ele disse, "então podemos alavancar esse fenômeno para fazer catalisadores muito melhores no futuro."

